题目
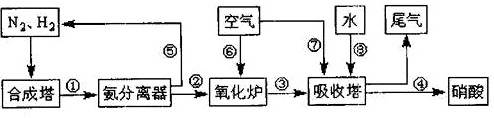
氨和肼(N2H4)既是工业原料,又是重要的化工产品,工业上由氨生产硝酸的工艺流程如图:N2、H2 空气 水 尾气-|||-⑤ ⑥ ⑦ ③-|||-、-|||-合成塔 ① 氨分离器 ② 氧化炉 ③ 吸收塔 ④ 硝酸(1)肼(N2H4)中氮元素的化合价为 ____ (2)实验室久置的浓硝酸发黄,请用化学方程式表示其原理 ____ .(3)肼在一定条件下可发生分解反应:3N2H4(g)⇌N2(g)+4NH3(g),已知断裂Imol N-H、N-N、N≡N分别需要吸收能量390.8kJ、193kJ、946kJ.则该反应的反应热△H= ____ kJ/mol.(4)某化学兴趣小组模拟NH3的合成,①在其它条件不变的情况下,改变n(H2)/n(N2)投料比与平衡时NH3的体积分数的关系如图1所示,则当(n((H)_(2)))/(n((N)_{2))}投料比为4时,达平衡后NH3的体积分数可能是图中的点 ____ (填“D”“E”或“F”).N2、H2 空气 水 尾气-|||-⑤ ⑥ ⑦ ③-|||-、-|||-合成塔 ① 氨分离器 ② 氧化炉 ③ 吸收塔 ④ 硝酸②现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2mol N2和6mol H2气体后发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H=-a kJ•mol-1,反应达到平衡状态时生成2mol NH3,放出热量Q1kJ;乙中加入2molNH3,反应达到平衡时,吸收热量Q2kJ,则Q1与Q2的相互关系正确的是 ____ .A.Q1+Q2=a B.Q1+2Q2<2a C.Q1+2Q2>2a D.Q1+Q2<a(5)氨在氧化炉主要有以下两个反应:a 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/molb 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1267kJ/mol①一定温度下,在2L的密闭容器中充入(10)/(3)mol NH3与3mol O2发生反应b,达到平衡后测得容器中NH3的物质的量为2mol,则反应b的化学平衡常数K= ____ .②一定温度下,在氧化炉中通入10molNH3发生反应 a,测得体系向外界释放2000kJ热量,则此时氨气的转化率为 ____ (结果保留两位小数). ③测得温度对NO、N2产率的影响如图2所示,下列说法错误的是 ____ .A.升高温度,反应 a和b的平衡常数均增大B.840℃后升高温度,反应a的正反应速率减小,反应b的正反应速率增大C.900℃后,NO产率下降的主要原因是反应a平衡逆向移动D.800℃左右时,氨的催化氧化主要按照反应a 进行.
氨和肼(N2H4)既是工业原料,又是重要的化工产品,工业上由氨生产硝酸的工艺流程如图:
(1)肼(N2H4)中氮元素的化合价为 ____
(2)实验室久置的浓硝酸发黄,请用化学方程式表示其原理 ____ .
(3)肼在一定条件下可发生分解反应:3N2H4(g)⇌N2(g)+4NH3(g),已知断裂Imol N-H、N-N、N≡N分别需要吸收能量390.8kJ、193kJ、946kJ.则该反应的反应热△H= ____ kJ/mol.
(4)某化学兴趣小组模拟NH3的合成,
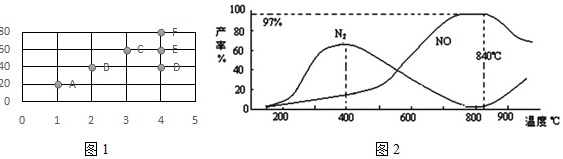
①在其它条件不变的情况下,改变n(H2)/n(N2)投料比与平衡时NH3的体积分数的关系如图1所示,则当$\frac{n({H}_{2})}{n({N}_{2})}$投料比为4时,达平衡后NH3的体积分数可能是图中的点 ____ (填“D”“E”或“F”).
②现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2mol N2和6mol H2气体后发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H=-a kJ•mol-1,反应达到平衡状态时生成2mol NH3,放出热量Q1kJ;乙中加入2molNH3,反应达到平衡时,吸收热量Q2kJ,则Q1与Q2的相互关系正确的是 ____ .
A.Q1+Q2=a B.Q1+2Q2<2a C.Q1+2Q2>2a D.Q1+Q2<a
(5)氨在氧化炉主要有以下两个反应:
a 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
b 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1267kJ/mol
①一定温度下,在2L的密闭容器中充入$\frac{10}{3}$mol NH3与3mol O2发生反应b,达到平衡后测得容器中NH3的物质的量为2mol,则反应b的化学平衡常数K= ____ .
②一定温度下,在氧化炉中通入10molNH3发生反应 a,测得体系向外界释放2000kJ热量,则此时氨气的转化率为 ____ (结果保留两位小数).
③测得温度对NO、N2产率的影响如图2所示,下列说法错误的是 ____ .
A.升高温度,反应 a和b的平衡常数均增大
B.840℃后升高温度,反应a的正反应速率减小,反应b的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应a平衡逆向移动
D.800℃左右时,氨的催化氧化主要按照反应a 进行.

(1)肼(N2H4)中氮元素的化合价为 ____
(2)实验室久置的浓硝酸发黄,请用化学方程式表示其原理 ____ .
(3)肼在一定条件下可发生分解反应:3N2H4(g)⇌N2(g)+4NH3(g),已知断裂Imol N-H、N-N、N≡N分别需要吸收能量390.8kJ、193kJ、946kJ.则该反应的反应热△H= ____ kJ/mol.
(4)某化学兴趣小组模拟NH3的合成,
①在其它条件不变的情况下,改变n(H2)/n(N2)投料比与平衡时NH3的体积分数的关系如图1所示,则当$\frac{n({H}_{2})}{n({N}_{2})}$投料比为4时,达平衡后NH3的体积分数可能是图中的点 ____ (填“D”“E”或“F”).

②现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2mol N2和6mol H2气体后发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H=-a kJ•mol-1,反应达到平衡状态时生成2mol NH3,放出热量Q1kJ;乙中加入2molNH3,反应达到平衡时,吸收热量Q2kJ,则Q1与Q2的相互关系正确的是 ____ .
A.Q1+Q2=a B.Q1+2Q2<2a C.Q1+2Q2>2a D.Q1+Q2<a
(5)氨在氧化炉主要有以下两个反应:
a 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=-905.5kJ/mol
b 4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g)△H=-1267kJ/mol
①一定温度下,在2L的密闭容器中充入$\frac{10}{3}$mol NH3与3mol O2发生反应b,达到平衡后测得容器中NH3的物质的量为2mol,则反应b的化学平衡常数K= ____ .
②一定温度下,在氧化炉中通入10molNH3发生反应 a,测得体系向外界释放2000kJ热量,则此时氨气的转化率为 ____ (结果保留两位小数).
③测得温度对NO、N2产率的影响如图2所示,下列说法错误的是 ____ .
A.升高温度,反应 a和b的平衡常数均增大
B.840℃后升高温度,反应a的正反应速率减小,反应b的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应a平衡逆向移动
D.800℃左右时,氨的催化氧化主要按照反应a 进行.
题目解答
答案
解:(1)根据物质呈电中性的原理,肼(N2H4)中,H呈+1价,则N的化合价为-2价,
故答案为:-2;
(2)实验室久置的浓硝酸发黄,是由于浓硝酸分解产生NO2,溶于硝酸导致,也产生O2,则其原理为:4HNO3=O2↑+4NO2↑+2H2O,
故答案为:4HNO3=O2↑+4NO2↑+2H2O;
(3)根据盖斯定律,反应的焓变△H=反应物总键能-生成物总键能,因此该反应的焓变△H=3[E(N-N)+4E(N-H)]-E(N≡N)-4×3E(N-H)=-367kJ/mol,
故答案为:-367;
(4)①合成氨的反应为:N2(g)+3H2(g)⇌2NH3(g),根据图1,改变物料比$\frac{n({H}_{2})}{n({N}_{2})}$与平衡的NH3体积分数的关系,当物料比按化学计量比投入时,产生NH3的量最大,反应物的转化率最高,所以C处的转化率最高,当物料比为4时 转化率要减少,故应为D点,故答案为:D;
②恒温恒容密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g),反应为放热反应,向甲中加入2mol N2和6mol H2气体后发生反应,反应达到平衡状态时生成2mol NH3,放出热量Q1kJ,反应转化了1molN2,3molH2,2molNH3,则Q1=a,故A,D均错,平衡时各组分浓度为c(N2)=$\frac{2-1}{1}$=1mol/L,c(H2)=$\frac{6-3}{1}$=3mol/L,c(NH3)=$\frac{2}{1}$=2mol/L,则反应的平衡常数为K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})c({N}_{2})}$=$\frac{(2mol/L)^{2}}{(3mol/L)^{3}×(1mol/L)}$=$\frac{4}{27}$L2/mol2,
温度不变,则平衡常数不变,乙中加入2molNH3,设反应生成了xmolN2,根据反应方程式,则平衡时各组分的浓度为c(N2)=xmol/L,c(H2)=3xmol/L,c(NH3)=(2-2x)mol/L,则有K=$\frac{(2-2x)^{2}}{(3x)^{3}•x}$═$\frac{4}{27}$,可得x=$\frac{-1+\sqrt{5}}{2}$<1,可见乙容器中,反应达到平衡时,Q2<a,但x=$\frac{\sqrt{5}-1}{2}>\frac{1}{2}$,因此Q2$>\frac{1}{2}$a,则Q1+2Q2$>a+\frac{1}{2}a×2=2a$,故C正确,B错误,
故答案为:C;
(5)①反应b为4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g),该反应的平衡常数为K=$\frac{{c}^{6}({H}_{2}O){c}^{2}({N}_{2})}{{c}^{3}({O}_{2}){c}^{4}(N{H}_{3})}$,一定温度下,在2L的密闭容器中充入$\frac{10}{3}$mol NH3与3mol O2发生反应b,达到平衡后测得容器中NH3的物质的量为2mol,则平衡时,容器中各组分的物质的量浓度为c(NH3)=$\frac{2}{2}$=1mol/L,c(O2)=$\frac{3-1}{2}$=1mol/L,c(N2)=$\frac{\frac{2}{3}}{2}$=$\frac{1}{3}$mol/L,c(H2O)=$\frac{2}{2}$=1mol/L,则反应b的化学平衡常数K=$\frac{(1mol/L)^{6}×(\frac{1}{3}mol/L)^{2}}{(1mol/L)^{3}×(1mol/L)^{4}}$=$\frac{1}{9}$mol/L,
故答案为:$\frac{1}{9}$mol/L;
②反应a为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),一定温度下,在氧化炉中通入10molNH3发生反应 a,测得体系向外界释放2000kJ热量,已知a反应的焓变为△H=-905.5kJ/mol,表明当4molNH3完全参加反应时,反应放出热量为905.5kJ,因此当反应向外界释放2000kJ能量时,转化的NH3的物质的量为△n=$4×\frac{2000}{905.5}$mol,则NH3的平衡转化率为α=$\frac{△n}{{n}_{总}}×100%$=88.35%
故答案为:88.35%;
③A.根据图2分析,升高温度,两个反应中的反应物产率并不是单纯地增大,因此平衡常数也不是单纯地随着温度升高而增大,故A错误;
B.升高温度,无论是对正反应速率,还是对逆反应速率,都是增大的,故B错误;
C.900℃后,NO产率,可知对于反应a,化学平衡向逆反应方向移动,故C正确;
D.800℃左右,根据图2,此时NO的产率最高,可知反应主要按反应a进行,故D正确.
故选AB.
故答案为:-2;
(2)实验室久置的浓硝酸发黄,是由于浓硝酸分解产生NO2,溶于硝酸导致,也产生O2,则其原理为:4HNO3=O2↑+4NO2↑+2H2O,
故答案为:4HNO3=O2↑+4NO2↑+2H2O;
(3)根据盖斯定律,反应的焓变△H=反应物总键能-生成物总键能,因此该反应的焓变△H=3[E(N-N)+4E(N-H)]-E(N≡N)-4×3E(N-H)=-367kJ/mol,
故答案为:-367;
(4)①合成氨的反应为:N2(g)+3H2(g)⇌2NH3(g),根据图1,改变物料比$\frac{n({H}_{2})}{n({N}_{2})}$与平衡的NH3体积分数的关系,当物料比按化学计量比投入时,产生NH3的量最大,反应物的转化率最高,所以C处的转化率最高,当物料比为4时 转化率要减少,故应为D点,故答案为:D;
②恒温恒容密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g),反应为放热反应,向甲中加入2mol N2和6mol H2气体后发生反应,反应达到平衡状态时生成2mol NH3,放出热量Q1kJ,反应转化了1molN2,3molH2,2molNH3,则Q1=a,故A,D均错,平衡时各组分浓度为c(N2)=$\frac{2-1}{1}$=1mol/L,c(H2)=$\frac{6-3}{1}$=3mol/L,c(NH3)=$\frac{2}{1}$=2mol/L,则反应的平衡常数为K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2})c({N}_{2})}$=$\frac{(2mol/L)^{2}}{(3mol/L)^{3}×(1mol/L)}$=$\frac{4}{27}$L2/mol2,
温度不变,则平衡常数不变,乙中加入2molNH3,设反应生成了xmolN2,根据反应方程式,则平衡时各组分的浓度为c(N2)=xmol/L,c(H2)=3xmol/L,c(NH3)=(2-2x)mol/L,则有K=$\frac{(2-2x)^{2}}{(3x)^{3}•x}$═$\frac{4}{27}$,可得x=$\frac{-1+\sqrt{5}}{2}$<1,可见乙容器中,反应达到平衡时,Q2<a,但x=$\frac{\sqrt{5}-1}{2}>\frac{1}{2}$,因此Q2$>\frac{1}{2}$a,则Q1+2Q2$>a+\frac{1}{2}a×2=2a$,故C正确,B错误,
故答案为:C;
(5)①反应b为4NH3(g)+3O2(g)⇌2N2(g)+6H2O(g),该反应的平衡常数为K=$\frac{{c}^{6}({H}_{2}O){c}^{2}({N}_{2})}{{c}^{3}({O}_{2}){c}^{4}(N{H}_{3})}$,一定温度下,在2L的密闭容器中充入$\frac{10}{3}$mol NH3与3mol O2发生反应b,达到平衡后测得容器中NH3的物质的量为2mol,则平衡时,容器中各组分的物质的量浓度为c(NH3)=$\frac{2}{2}$=1mol/L,c(O2)=$\frac{3-1}{2}$=1mol/L,c(N2)=$\frac{\frac{2}{3}}{2}$=$\frac{1}{3}$mol/L,c(H2O)=$\frac{2}{2}$=1mol/L,则反应b的化学平衡常数K=$\frac{(1mol/L)^{6}×(\frac{1}{3}mol/L)^{2}}{(1mol/L)^{3}×(1mol/L)^{4}}$=$\frac{1}{9}$mol/L,
故答案为:$\frac{1}{9}$mol/L;
②反应a为4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),一定温度下,在氧化炉中通入10molNH3发生反应 a,测得体系向外界释放2000kJ热量,已知a反应的焓变为△H=-905.5kJ/mol,表明当4molNH3完全参加反应时,反应放出热量为905.5kJ,因此当反应向外界释放2000kJ能量时,转化的NH3的物质的量为△n=$4×\frac{2000}{905.5}$mol,则NH3的平衡转化率为α=$\frac{△n}{{n}_{总}}×100%$=88.35%
故答案为:88.35%;
③A.根据图2分析,升高温度,两个反应中的反应物产率并不是单纯地增大,因此平衡常数也不是单纯地随着温度升高而增大,故A错误;
B.升高温度,无论是对正反应速率,还是对逆反应速率,都是增大的,故B错误;
C.900℃后,NO产率,可知对于反应a,化学平衡向逆反应方向移动,故C正确;
D.800℃左右,根据图2,此时NO的产率最高,可知反应主要按反应a进行,故D正确.
故选AB.