题目
四、(18分)苯在正常沸点353 K时摩尔汽化焓为3075 kJ·mol1。今将353 K,101325 kPa下的1 mol液态苯向真空等温蒸发变为同温同压的苯蒸气(设为理想气体)。(1)求此过程的Q,W,U,H,S,F(A)和G;(2)应用有关原理,判断此过程是否为不可逆过程。
四、(18分)苯在正常沸点353 K时摩尔汽化焓为3075 kJ·mol1。今将353 K,101325 kPa下的1 mol液态苯向真空等温蒸发变为同温同压的苯蒸气(设为理想气体)。
(1)求此过程的Q,W,U,H,S,F(A)和G;
(2)应用有关原理,判断此过程是否为不可逆过程。
题目解答
答案
解:(1) 定温可逆相变与向真空蒸发(不可逆相变)的终态相同,故两种变化途径的状态函数变化相等,即:
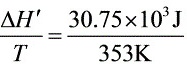 G = G’ = 0 H = H’ = 1mol×30.75 kJ·mol = 30.75 kJ
G = G’ = 0 H = H’ = 1mol×30.75 kJ·mol = 30.75 kJ
S = 87.11 J·K1
U = U’ = H’-pV = H’-nRT = 30.75 kJ-1 mol×8.314 J·K1·mol1×353 K= 27.82 kJ
A = U-TS = 27.82 kJ-353 K×87.11×103 kJ·K1 =-2.93 kJ
向真空蒸发,pex = 0,故W = 0
因 U = Q + W 所以 Q = U = 2782 kJ
(2)由(1)的计算结果可知,Ar < W,故过程不可逆。
解析
步骤 1:计算焓变(H)
定温可逆相变与向真空蒸发(不可逆相变)的终态相同,故两种变化途径的状态函数变化相等,即:
H = H’ = 1mol×30.75 kJ·mol = 30.75 kJ
步骤 2:计算熵变(S)
$\dfrac {\Delta H'}{T}=\dfrac {30.75\times {10}^{3}J}{353K}$ = 87.11 J·K1
步骤 3:计算内能变(U)
U = U’ = H’-pV = H’-nRT = 30.75 kJ-1 mol×8.314 J·K1·mol1×353 K= 27.82 kJ
步骤 4:计算吉布斯自由能变(G)
G = G’ = 0
步骤 5:计算亥姆霍兹自由能变(A)
A = U-TS = 27.82 kJ-353 K×87.11×103 kJ·K1 =-2.93 kJ
步骤 6:计算功(W)
向真空蒸发,pex = 0,故W = 0
步骤 7:计算热(Q)
因 U = Q + W 所以 Q = U = 2782 kJ
步骤 8:判断过程是否为不可逆过程
由(1)的计算结果可知,Ar < W,故过程不可逆。
定温可逆相变与向真空蒸发(不可逆相变)的终态相同,故两种变化途径的状态函数变化相等,即:
H = H’ = 1mol×30.75 kJ·mol = 30.75 kJ
步骤 2:计算熵变(S)
$\dfrac {\Delta H'}{T}=\dfrac {30.75\times {10}^{3}J}{353K}$ = 87.11 J·K1
步骤 3:计算内能变(U)
U = U’ = H’-pV = H’-nRT = 30.75 kJ-1 mol×8.314 J·K1·mol1×353 K= 27.82 kJ
步骤 4:计算吉布斯自由能变(G)
G = G’ = 0
步骤 5:计算亥姆霍兹自由能变(A)
A = U-TS = 27.82 kJ-353 K×87.11×103 kJ·K1 =-2.93 kJ
步骤 6:计算功(W)
向真空蒸发,pex = 0,故W = 0
步骤 7:计算热(Q)
因 U = Q + W 所以 Q = U = 2782 kJ
步骤 8:判断过程是否为不可逆过程
由(1)的计算结果可知,Ar < W,故过程不可逆。