二、填空题(共小题,共分).按要求填空。()在-、+、+、+、、-、+中,只有氧化性的是,只有还原性的是,既有氧化性又有还原性的是。()某同学写出以下三个化学方程式:(未配平)①+―→+②+―→+③+―→+其中你认为不可能实现的是(填序号)。()下列三个氧化还原反应中,氧化性最强的物质是。若溶质中-与-共存,为了氧化-而-不被氧化,除单质外,还应用反应中的作氧化剂。①+++②+③+(浓)++↑+.以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D请回答下列问题:()在炉气制造中,黄铁矿粉碎的目的是,生成二氧化硫的化学方程式是。()炉气精制的目的是。()二氧化硫催化氧化的化学方程式是。()浓硫酸是不是可以用水代替:,原因是。()尾气的主要成分是,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是。.某化学兴趣小组为探究、、+的氧化性强弱,设计了如下实验:精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D()①装置中发生反应的离子方程式是。②整套实验装置存在一处明显的不足,请指出。()用改正后的装置进行实验,实验过程如下:精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D()因忙于观察和记录,没有及时停止反应,、中均发生了新的变化。装置中:红色慢慢褪去。装置中:层先由无色变为橙色,后颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料如下:.精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D是一个可逆反应。.精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D性质与卤素单质类似、氧化性:精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D。.精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D呈红色(略带黄色),沸点约精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D,它与水能发生水解反应,且该反应为非氧化还原反应。.精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D。①用平衡移动原理(结合上述资料)解释过量时中溶液红色褪去的原因,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加溶液,若溶液颜色,则上述解释是合理的。②探究中颜色变化的原因,设计实验如下:用分液漏斗分离出的下层溶液,蒸馏、收集红色物质,取少量,加入溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:。.铁是人体必需的微量元素之一,没有铁,血红蛋白就不能结合氧分子进行输氧,所以缺少铁元素,人体易患的疾病为贫血,医学上经常用硫酸亚铁糖衣片给这种病人补铁。小陈同学对这种糖衣片产生了兴趣,进行探究实验如下:()提出问题这种糖衣片中是否含有硫酸亚铁,若有,含量是多少?()查阅资料①亚铁离子遇具有氧化性的物质时易被氧化。如氢氧化亚铁为白色沉淀,在空气中会迅速被氧化成红褐色的氢氧化铁沉淀,这是氢氧化亚铁的典型特征。②亚铁盐溶于水时,会产生少量氢氧根离子而产生沉淀(溶液浑浊)。()实验验证①鉴定硫酸亚铁的成分时需加水溶解,加滴稀盐酸的作用是,能否用稀硫酸代替(填“能”或“不能”)。②为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是(选填“”或“”)。.用硝酸酸化的硝酸钡溶液.用盐酸酸化的氯化钡溶液③检验亚铁盐可用的试剂是,现象为。()含量测定①取十粒糖衣片,称其质量为 ,溶于 水中;溶解药品时用到玻璃棒的作用是。②向所配溶液中滴加氯化钡溶液至略过量;证明溶液过量的操作为静置,向上层清液中滴加溶液,若现象为,则溶液已过量。③过滤、洗涤、干燥;洗涤沉淀的操作:用玻璃棒(填一操作名),向过滤器中加入蒸馏水至淹没沉淀,待液体滤出。重复操作~次。证明沉淀已洗净的方法是。④称量得沉淀质量为 ,列式计算该糖衣片中硫酸亚铁的质量分数:。()总结反思对硫酸亚铁来说,药片的糖衣起到的作用是。.某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:精制炉气 98.3%H2SO4-|||-约440℃-|||-催化剂 尾-|||-800℃-|||-黄铁 热交-|||-矿貌 对 精制炉气-|||--50=0 SO2-|||-空气 矿渣 " 约120 ℃ 品产-|||-炉气 炉气 SO2催化氧化 SO3吸收-|||-制造 精制-|||-A B C D()装置的作用是,烧瓶底部放碎瓷片的作用是。()装置中发生反应的化学方程式是,该反应中氧化剂是,氧化产物是。()的作用是。()中的实验现象是。()、两个装置中应先点燃处的酒精(喷)灯,点燃处酒精灯之前应进行的操作是。.
二、填空题(共小题,共分)
.按要求填空。
()在-、+、+、+、、-、+中,只有氧化性的是,只有还原性的是,既有氧化性又有还原性的是。
()某同学写出以下三个化学方程式:(未配平)
①+―→+
②+―→+
③+―→+
其中你认为不可能实现的是(填序号)。
()下列三个氧化还原反应中,氧化性最强的物质是。若溶质中-与-共存,为了氧化-而-不被氧化,除单质外,还应用反应中的作氧化剂。
①+++
②+
③+(浓)++↑+
.以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:
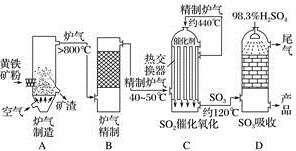
请回答下列问题:
()在炉气制造中,黄铁矿粉碎的目的是,生成二氧化硫的化学方程式是。
()炉气精制的目的是。
()二氧化硫催化氧化的化学方程式是。
()浓硫酸是不是可以用水代替:,原因是。
()尾气的主要成分是,若将尾气通入氢氧化钙浊液中,最后能得到的副产品是。
.某化学兴趣小组为探究、、+的氧化性强弱,设计了如下实验:
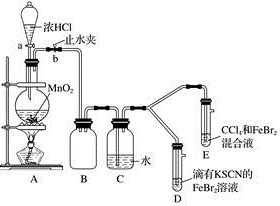
()①装置中发生反应的离子方程式是。
②整套实验装置存在一处明显的不足,请指出。
()用改正后的装置进行实验,实验过程如下:
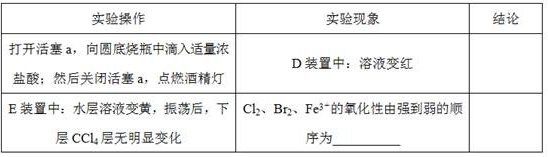
()因忙于观察和记录,没有及时停止反应,、中均发生了新的变化。装置中:红色慢慢褪去。装置中:层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
. 是一个可逆反应。
是一个可逆反应。
.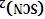 性质与卤素单质类似、氧化性:
性质与卤素单质类似、氧化性: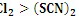 。
。
. 呈红色(略带黄色),沸点约
呈红色(略带黄色),沸点约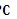 ,它与水能发生水解反应,且该反应为非氧化还原反应。
,它与水能发生水解反应,且该反应为非氧化还原反应。
. 。
。
①用平衡移动原理(结合上述资料)解释过量时中溶液红色褪去的原因,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加溶液,若溶液颜色,则上述解释是合理的。
②探究中颜色变化的原因,设计实验如下:
用分液漏斗分离出的下层溶液,蒸馏、收集红色物质,取少量,加入溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:。
.铁是人体必需的微量元素之一,没有铁,血红蛋白就不能结合氧分子进行输氧,所以缺少铁元素,人体易患的疾病为贫血,医学上经常用硫酸亚铁糖衣片给这种病人补铁。小陈同学对这种糖衣片产生了兴趣,进行探究实验如下:
()提出问题
这种糖衣片中是否含有硫酸亚铁,若有,含量是多少?
()查阅资料
①亚铁离子遇具有氧化性的物质时易被氧化。如氢氧化亚铁为白色沉淀,在空气中会迅速被氧化成红褐色的氢氧化铁沉淀,这是氢氧化亚铁的典型特征。
②亚铁盐溶于水时,会产生少量氢氧根离子而产生沉淀(溶液浑浊)。
()实验验证
①鉴定硫酸亚铁的成分时需加水溶解,加滴稀盐酸的作用是,能否用稀硫酸代替(填“能”或“不能”)。
②为了不影响后续检验亚铁盐,检验硫酸盐可用的试剂是(选填“”或“”)。
.用硝酸酸化的硝酸钡溶液
.用盐酸酸化的氯化钡溶液
③检验亚铁盐可用的试剂是,现象为。
()含量测定
①取十粒糖衣片,称其质量为 ,溶于 水中;溶解药品时用到玻璃棒的作用是。
②向所配溶液中滴加氯化钡溶液至略过量;证明溶液过量的操作为静置,向上层清液中滴加溶液,若现象为,则溶液已过量。
③过滤、洗涤、干燥;洗涤沉淀的操作:用玻璃棒(填一操作名),向过滤器中加入蒸馏水至淹没沉淀,待液体滤出。重复操作~次。证明沉淀已洗净的方法是。
④称量得沉淀质量为 ,列式计算该糖衣片中硫酸亚铁的质量分数:。
()总结反思
对硫酸亚铁来说,药片的糖衣起到的作用是。
.某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
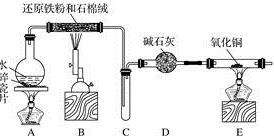
()装置的作用是,烧瓶底部放碎瓷片的作用是。
()装置中发生反应的化学方程式是,该反应中氧化剂是,氧化产物是。
()的作用是。
()中的实验现象是。
()、两个装置中应先点燃处的酒精(喷)灯,点燃处酒精灯之前应进行的操作是。
.题目解答
答案
答案
.()+、+、+ -、- +、 ()② ()
.()增大反应接触的表面积,加快反应速率 +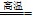 +
+
()防止催化剂中毒
()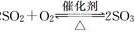
()不可以 避免用水吸收三氧化硫形成酸雾
()二氧化硫、三氧化硫和空气 石膏
.()①+++-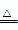 ++↑+ ②缺少尾气处理装置
++↑+ ②缺少尾气处理装置
()> > +
()①过量氯气和-反应-+-+(),使-浓度减小,则++-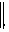 ()平衡逆向移动而褪色 变红色 (或 溶液,不变红)
()平衡逆向移动而褪色 变红色 (或 溶液,不变红)
②++、++-↓
.()①加入盐酸酸化,可有效降低亚铁盐还原性,防止氧化 不能
②
③氢氧化钠溶液 产生白色沉淀并迅速变成红褐色沉淀
()①搅拌以促进溶解
②氯化钡 不再产生白色沉淀
③引流 取最后一次洗涤所得的滤液,滴入硝酸银溶液,若无白色沉淀产生,则已洗净
④
()隔绝氧气,防止硫酸亚铁被氧化而失效
.()产生水蒸气 防止加热时液体暴沸 ()+()+ ()吸收未反应的水蒸气(或干燥) ()黑色固体变成红色,玻璃管内壁上有水珠生成 () 收集并检验其纯度
.