题目
有机物异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注,其主要反应如下:Ⅰ.C3H8O(g)⇌C3H6(g)+H2O(g)△H1=+52kJ/molⅡ.2C3H6(g)=C6H12(g)△H2=-97kJ/mol在1350℃下,恒容密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表: 反应时间/μs 0 4 8 12 t 20 H2O浓度/ppm 0 2440 3200 3600 4000 4100 (1)4~8μs内,v(C3H8O)= ____ ppm/μs。(2)t ____ 16(填“>”、“<”或“=”)。(3)在恒温恒容密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是 ____ (双选)。A.H2O(g)的浓度不变B.混合气体密度不变C.n(C3H6)=n(C6H12)D.v正(H2O)=v逆(C3H8O)(4)当2v正(C3H6)=v逆(C6H12)时,反应Ⅱ处于 ____ (填写“正向进行”、“逆向进行”或“化学平衡状态”)。假设某恒容容器内只发生反应Ⅱ(仅存在C3H6和C6H12两种物质),若要使反应Ⅱ达到平衡后,向正反应方向移动,可以改变的条件是 ____ (列举两条)。如图为反应Ⅰ、Ⅱ达到平衡时1gK与温度的关系曲线。6-|||-4-|||-曲线M-|||-甲-|||-2 曲线N 丙-|||-0 于-|||--2 戊-|||-4-|||-150 200 250 300 350 400-|||-温度/℃(5)根据反应热效应,判断曲线M对应反应 ____ (填写“Ⅰ”或“Ⅱ”),判断依据为 ____ 。(6)在350℃恒容平衡体系中充入少量水蒸气时,此刻反应Ⅰ的状态最有可能对应图中的 ____ 点(填“甲”、“乙”、“丙”、“丁”或“戊”),判断依据是 ____ 。(7)350℃时,在密闭恒容容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的物质的量浓度为xmol/L,C3H6的物质的量浓度为 ____ mol/L(用含x的代数式表示)。
有机物异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.C3H8O(g)⇌C3H6(g)+H2O(g)△H1=+52kJ/mol
Ⅱ.2C3H6(g)=C6H12(g)△H2=-97kJ/mol
在1350℃下,恒容密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
(1)4~8μs内,v(C3H8O)= ____ ppm/μs。
(2)t ____ 16(填“>”、“<”或“=”)。
(3)在恒温恒容密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是 ____ (双选)。
A.H2O(g)的浓度不变
B.混合气体密度不变
C.n(C3H6)=n(C6H12)
D.v正(H2O)=v逆(C3H8O)
(4)当2v正(C3H6)=v逆(C6H12)时,反应Ⅱ处于 ____ (填写“正向进行”、“逆向进行”或“化学平衡状态”)。假设某恒容容器内只发生反应Ⅱ(仅存在C3H6和C6H12两种物质),若要使反应Ⅱ达到平衡后,向正反应方向移动,可以改变的条件是 ____ (列举两条)。
如图为反应Ⅰ、Ⅱ达到平衡时1gK与温度的关系曲线。
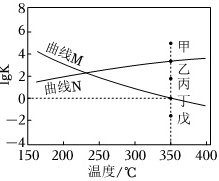
(5)根据反应热效应,判断曲线M对应反应 ____ (填写“Ⅰ”或“Ⅱ”),判断依据为 ____ 。
(6)在350℃恒容平衡体系中充入少量水蒸气时,此刻反应Ⅰ的状态最有可能对应图中的 ____ 点(填“甲”、“乙”、“丙”、“丁”或“戊”),判断依据是 ____ 。
(7)350℃时,在密闭恒容容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的物质的量浓度为xmol/L,C3H6的物质的量浓度为 ____ mol/L(用含x的代数式表示)。
Ⅰ.C3H8O(g)⇌C3H6(g)+H2O(g)△H1=+52kJ/mol
Ⅱ.2C3H6(g)=C6H12(g)△H2=-97kJ/mol
在1350℃下,恒容密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
| 反应时间/μs | 0 | 4 | 8 | 12 | t | 20 |
| H2O浓度/ppm | 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
(2)t ____ 16(填“>”、“<”或“=”)。
(3)在恒温恒容密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是 ____ (双选)。
A.H2O(g)的浓度不变
B.混合气体密度不变
C.n(C3H6)=n(C6H12)
D.v正(H2O)=v逆(C3H8O)
(4)当2v正(C3H6)=v逆(C6H12)时,反应Ⅱ处于 ____ (填写“正向进行”、“逆向进行”或“化学平衡状态”)。假设某恒容容器内只发生反应Ⅱ(仅存在C3H6和C6H12两种物质),若要使反应Ⅱ达到平衡后,向正反应方向移动,可以改变的条件是 ____ (列举两条)。
如图为反应Ⅰ、Ⅱ达到平衡时1gK与温度的关系曲线。

(5)根据反应热效应,判断曲线M对应反应 ____ (填写“Ⅰ”或“Ⅱ”),判断依据为 ____ 。
(6)在350℃恒容平衡体系中充入少量水蒸气时,此刻反应Ⅰ的状态最有可能对应图中的 ____ 点(填“甲”、“乙”、“丙”、“丁”或“戊”),判断依据是 ____ 。
(7)350℃时,在密闭恒容容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的物质的量浓度为xmol/L,C3H6的物质的量浓度为 ____ mol/L(用含x的代数式表示)。
题目解答
答案
解:(1)4~8µs内,v(H2O)=$\frac{3200-2440}{8-4}$ppm•µs-1=190ppm•µs-1,则v(C3H8O)=v(H2O)=190ppm•µs-1,
故答案为:190;
(2)0~4µs、4~8µs、8~12µs,△c(H2O)逐渐减小,说明反应速率减小,8~12µs内,△c(H2O)=400ppm,12~tµs内,△c(H2O)=400ppm,则t-12>4,即t>16,
故答案为:>;
(3)A.H2O的分压不变,则C3H6的分压也不变,反应I、II各组分分压不变,反应I、II均达到平衡,故A正确;
B.反应物和生成物均为气体,混合气体的总质量不变,刚性密闭容器体积不变,则混合气体密度不变,是个不变量,不能作为反应I、II均达到平衡的判据,故B错误;
C.当n(C3H6)=2n(C6H12)时,反应不一定达到平衡,不能作为反应I、II均达到平衡的判据,故C错误;
D.v正(H2O)=v逆(C3H8O),说明正逆反应速率相等,反应I达平衡,反应I达平衡,各组分分压不变,C3H6的分压不变,说明反应II也达平衡,故D正确;
故答案为:AD;
(4)由反应Ⅱ可知,当v正(C3H6)=2v逆(C6H12)时,反应Ⅱ达到平衡状态,当2v正(C3H6)=v逆(C6H12)时,说明v正<v逆,则反应逆向进行,若只发生反应Ⅱ,结合反应Ⅱ为放热反应,且反应为气体分子数减小的反应,若要使反应Ⅱ达到平衡后,向正反应方向移动,可以改变的条件是:降低温度或增大压强,
故答案为:降低温度或增大压强;
(5)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,升高温度平衡Ⅰ平衡正向进行,K增大,反应Ⅱ平衡逆向进行,K减小,结合图象可知曲线M对应反应Ⅱ,曲线N对应反应Ⅰ,
故答案为:Ⅱ;反应Ⅱ为放热反应,升高温度反应Ⅱ平衡逆向进行,K减小;
(6)反应I为气体体积增大的吸热反应,反应II为气体体积减小的放热反应,则升高温度,反应I正向移动,Qp逐渐增大,反应II逆向移动,Qp逐渐减小,即反应I平衡曲线为N,反应II平衡曲线为M;在350°C恒压平衡体系中充入少量水蒸气时,对于反应I而言,相当于增大生成物浓度,使得Qp>Kp,反应I的状态最有可能对应图中的甲,
故答案为:甲;反应I平衡曲线为N,恒压时充入水蒸气,Qp>Kp;
(7)由图可知,350°C时达平衡后,lgQP=0,则350°C时Kp=Qp=1,测得C6H12的物质的量浓度为xmol/L,可逆反应 2C3H6(g)⇌C6H12(g),反应的平衡常数K=$\frac{c({c}_{6}{H}_{12})}{{c}^{2}({c}_{3}{H}_{6})}$=1,则C3H6的物质的量浓度为$\sqrt{x}$mol/L,
故答案为:$\sqrt{x}$。
故答案为:190;
(2)0~4µs、4~8µs、8~12µs,△c(H2O)逐渐减小,说明反应速率减小,8~12µs内,△c(H2O)=400ppm,12~tµs内,△c(H2O)=400ppm,则t-12>4,即t>16,
故答案为:>;
(3)A.H2O的分压不变,则C3H6的分压也不变,反应I、II各组分分压不变,反应I、II均达到平衡,故A正确;
B.反应物和生成物均为气体,混合气体的总质量不变,刚性密闭容器体积不变,则混合气体密度不变,是个不变量,不能作为反应I、II均达到平衡的判据,故B错误;
C.当n(C3H6)=2n(C6H12)时,反应不一定达到平衡,不能作为反应I、II均达到平衡的判据,故C错误;
D.v正(H2O)=v逆(C3H8O),说明正逆反应速率相等,反应I达平衡,反应I达平衡,各组分分压不变,C3H6的分压不变,说明反应II也达平衡,故D正确;
故答案为:AD;
(4)由反应Ⅱ可知,当v正(C3H6)=2v逆(C6H12)时,反应Ⅱ达到平衡状态,当2v正(C3H6)=v逆(C6H12)时,说明v正<v逆,则反应逆向进行,若只发生反应Ⅱ,结合反应Ⅱ为放热反应,且反应为气体分子数减小的反应,若要使反应Ⅱ达到平衡后,向正反应方向移动,可以改变的条件是:降低温度或增大压强,
故答案为:降低温度或增大压强;
(5)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,升高温度平衡Ⅰ平衡正向进行,K增大,反应Ⅱ平衡逆向进行,K减小,结合图象可知曲线M对应反应Ⅱ,曲线N对应反应Ⅰ,
故答案为:Ⅱ;反应Ⅱ为放热反应,升高温度反应Ⅱ平衡逆向进行,K减小;
(6)反应I为气体体积增大的吸热反应,反应II为气体体积减小的放热反应,则升高温度,反应I正向移动,Qp逐渐增大,反应II逆向移动,Qp逐渐减小,即反应I平衡曲线为N,反应II平衡曲线为M;在350°C恒压平衡体系中充入少量水蒸气时,对于反应I而言,相当于增大生成物浓度,使得Qp>Kp,反应I的状态最有可能对应图中的甲,
故答案为:甲;反应I平衡曲线为N,恒压时充入水蒸气,Qp>Kp;
(7)由图可知,350°C时达平衡后,lgQP=0,则350°C时Kp=Qp=1,测得C6H12的物质的量浓度为xmol/L,可逆反应 2C3H6(g)⇌C6H12(g),反应的平衡常数K=$\frac{c({c}_{6}{H}_{12})}{{c}^{2}({c}_{3}{H}_{6})}$=1,则C3H6的物质的量浓度为$\sqrt{x}$mol/L,
故答案为:$\sqrt{x}$。