题目
9. 某一级反应A→产物,初始速率为1×10-3mol·dm-3·min-1,1h后速率为0.25×10-3mol·dm-3·min-1,求k,t1/2和初始浓度cA,0。
9. 某一级反应A→产物,初始速率为1×10-3mol·dm-3·min-1,1h后速率为0.25×10-3mol·dm-3·min-1,求k,t1/2和初始浓度cA,0。
题目解答
答案

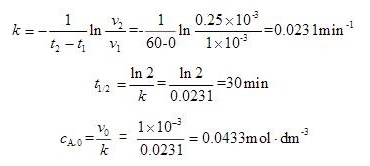
解析
步骤 1:确定速率方程
对于一级反应,速率方程为 $v = k{c}_{A}$,其中 $v$ 是反应速率,$k$ 是速率常数,${c}_{A}$ 是反应物A的浓度。对于一级反应,速率常数 $k$ 与时间 $t$ 的关系为 $\ln \dfrac {{C}_{A}O}{{C}_{A}}=kt$,其中 ${C}_{A}O$ 是初始浓度,${C}_{A}$ 是时间 $t$ 时的浓度。
步骤 2:计算速率常数 $k$
根据题目给出的初始速率 $v_0 = 1 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$ 和1小时后的速率 $v_1 = 0.25 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$,可以使用速率方程 $v = k{c}_{A}$ 来计算速率常数 $k$。由于速率与浓度成正比,我们可以使用速率比来计算速率常数 $k$:
$$k = -\dfrac {1}{{t}_{2}-{t}_{1}}\ln \dfrac {{v}_{2}}{{v}_{1}}$$
其中 ${t}_{1} = 0$,${t}_{2} = 60$ 分钟,${v}_{1} = 1 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$,${v}_{2} = 0.25 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$。
步骤 3:计算半衰期 $t_{1/2}$
半衰期 $t_{1/2}$ 是反应物浓度减少到初始浓度一半所需的时间,对于一级反应,$t_{1/2} = \dfrac {\ln 2}{k}$。
步骤 4:计算初始浓度 ${c}_{A,0}$
初始浓度 ${c}_{A,0}$ 可以通过速率方程 $v = k{c}_{A}$ 来计算,其中 $v$ 是初始速率,$k$ 是速率常数,${c}_{A}$ 是初始浓度。
对于一级反应,速率方程为 $v = k{c}_{A}$,其中 $v$ 是反应速率,$k$ 是速率常数,${c}_{A}$ 是反应物A的浓度。对于一级反应,速率常数 $k$ 与时间 $t$ 的关系为 $\ln \dfrac {{C}_{A}O}{{C}_{A}}=kt$,其中 ${C}_{A}O$ 是初始浓度,${C}_{A}$ 是时间 $t$ 时的浓度。
步骤 2:计算速率常数 $k$
根据题目给出的初始速率 $v_0 = 1 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$ 和1小时后的速率 $v_1 = 0.25 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$,可以使用速率方程 $v = k{c}_{A}$ 来计算速率常数 $k$。由于速率与浓度成正比,我们可以使用速率比来计算速率常数 $k$:
$$k = -\dfrac {1}{{t}_{2}-{t}_{1}}\ln \dfrac {{v}_{2}}{{v}_{1}}$$
其中 ${t}_{1} = 0$,${t}_{2} = 60$ 分钟,${v}_{1} = 1 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$,${v}_{2} = 0.25 \times 10^{-3} mol \cdot dm^{-3} \cdot min^{-1}$。
步骤 3:计算半衰期 $t_{1/2}$
半衰期 $t_{1/2}$ 是反应物浓度减少到初始浓度一半所需的时间,对于一级反应,$t_{1/2} = \dfrac {\ln 2}{k}$。
步骤 4:计算初始浓度 ${c}_{A,0}$
初始浓度 ${c}_{A,0}$ 可以通过速率方程 $v = k{c}_{A}$ 来计算,其中 $v$ 是初始速率,$k$ 是速率常数,${c}_{A}$ 是初始浓度。