(10分)(2014秋•正定县校级期中)饮用水中的NO3﹣对人类健康会产生危害,为了降低饮用水中NO3﹣的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3﹣还原为N2,其化学方程式为Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O (未配平).请回答下列问题:(1)上述反应中,Al元素的化合价升高,则该元素的原子失去(填“得到”或“失去”)电子;而N元素的化合价降低,则该元素的原子被还原(填“氧化”或“还原”).(2)配平上述反应:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O(3)用“双线桥法”表示反应中电子转移的方向和数目:(H)_(2)+(H)_(N)(H)_(2)N(O)_(3)+4NaOH=10NaAl(O)_(2)+3(N)_(2)uparrow +2(H)_(2)O-|||-得到6×5e^-A.钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑B.金属铝溶于氢氧化钠溶液:Al+2OH﹣=AlO+H2↑C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑D.AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓8.(2分)(2013秋•攀枝花期末)今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子的物质的量之比是()A.1:1:1B.3:2:2C.3:2:3D.1:1:39.(2分)(2014秋•正定县校级期中)能正确表示下列反应的离子方程式是()A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2OD.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH﹣+O2↑10.(2分)(2014秋•正定县校级期中)下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是()A.Na和O2B.Ca(OH)2溶液和CO2C.Zn和稀硫酸D.AlCl3和NaOH11.(2分)(2014秋•分宜县校级期中)R、X、Y和Z四种元素,它们常见的化合价均为+2价,且X2+与单质R不反应;X2++Z═X+Z2+;Y+Z2+═Y2++Z.这四种离子被还原成0价时,表现的氧化性强弱顺序正确的是()A.R2+>X2+>Z2+>Y2+B.X2+>R2+>Y2+>Z2+C.Y2+>Z2+>R2+>X2+D.Z2+>X2+>R2+>Y2+12.(2分)(2014秋•正定县校级期中)下列物质的鉴别方法不正确的是()A.用焰色反应鉴别NaCl、KCl和Na2SO4B.用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液C.利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液D.用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液(4)上述反应中若标准状况下产生11.2L气体物质,则转移电子的数目为3.01×1024或者5NA.考点:氧化还原反应;氧化还原反应的电子转移数目计算;氧化还原反应方程式的配平. 分析:Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目.解答:解:(1)Al元素的化合价升高,失去电子,Al被氧化作还原剂,NaNO3中N元素化合价降低得电子,被还原,故答案为:Al;失去; N;还原;(2)反应中Al→AlO2﹣,Al元素化合价由价升高为+3价,共升高3价,NO3﹣→N2↑,氮元素化合价由+5价降低为价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH﹣系数为4,由H元素守恒可知H2O前面的系数为2,方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,故答案为:10;6;4;10;3;2;(3)该反应中只有Al元素失电子化合价升高,Al元素化合价由价变为+3价,所以10molAl完全反应转移电子的物质的量为30mol,则转移电子数为30NA;该反应中Al元素化合价由价变为+3价,N元素化合价由+5价变为价,根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为,故答案为:;(4)产生11.2L气体,物质的量为0.5mol,则转移的电子的物质的量为0.5mol×2×(5﹣)=5mol,数目为3.01×1024或者5NA,故答案为:3.01×1024或者5NA点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大..
(10分)(2014秋•正定县校级期中)饮用水中的NO3﹣对人类健康会产生危害,为了降低饮用水中NO3﹣的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3﹣还原为N2,其化学方程式为Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O (未配平).请回答下列问题:
(1)上述反应中,Al元素的化合价升高,则该元素的原子失去(填“得到”或“失去”)电子;而N元素的化合价降低,则该元素的原子被还原(填“氧化”或“还原”).
(2)配平上述反应:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目: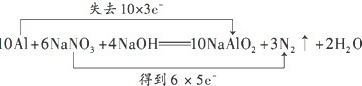
A.
钠和冷水反应:Na+2H2O=Na++2OH﹣+H2↑
B.
金属铝溶于氢氧化钠溶液:Al+2OH﹣=AlO+H2↑
C.
金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.
AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓
8.(2分)(2013秋•攀枝花期末)今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子的物质的量之比是()
A.
1:1:1
B.
3:2:2
C.
3:2:3
D.
1:1:3
9.(2分)(2014秋•正定县校级期中)能正确表示下列反应的离子方程式是()
A.
浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.
明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C.
Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
D.
Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH﹣+O2↑
10.(2分)(2014秋•正定县校级期中)下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是()
A.
Na和O2
B.
Ca(OH)2溶液和CO2
C.
Zn和稀硫酸
D.
AlCl3和NaOH
11.(2分)(2014秋•分宜县校级期中)R、X、Y和Z四种元素,它们常见的化合价均为+2价,且X2+与单质R不反应;X2++Z═X+Z2+;Y+Z2+═Y2++Z.这四种离子被还原成0价时,表现的氧化性强弱顺序正确的是()
A.
R2+>X2+>Z2+>Y2+
B.
X2+>R2+>Y2+>Z2+
C.
Y2+>Z2+>R2+>X2+
D.
Z2+>X2+>R2+>Y2+
12.(2分)(2014秋•正定县校级期中)下列物质的鉴别方法不正确的是()
A.
用焰色反应鉴别NaCl、KCl和Na2SO4
B.
用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液
C.
利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液
D.
用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液
(4)上述反应中若标准状况下产生11.2L气体物质,则转移电子的数目为3.01×1024或者5NA.
考点:
氧化还原反应;氧化还原反应的电子转移数目计算;氧化还原反应方程式的配平.
分析:
Al+NaNO3+NaOH﹣NaAlO2+N2↑+H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目.
解答:
解:(1)Al元素的化合价升高,失去电子,Al被氧化作还原剂,NaNO3中N元素化合价降低得电子,被还原,
故答案为:Al;失去; N;还原;
(2)反应中Al→AlO2﹣,Al元素化合价由价升高为+3价,共升高3价,NO3﹣→N2↑,氮元素化合价由+5价降低为价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH﹣系数为4,由H元素守恒可知H2O前面的系数为2,方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,
故答案为:10;6;4;10;3;2;
(3)该反应中只有Al元素失电子化合价升高,Al元素化合价由价变为+3价,所以10molAl完全反应转移电子的物质的量为30mol,则转移电子数为30NA;该反应中Al元素化合价由价变为+3价,N元素化合价由+5价变为价,根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为,
故答案为:;
(4)产生11.2L气体,物质的量为0.5mol,则转移的电子的物质的量为0.5mol×2×(5﹣)=5mol,数目为3.01×1024或者5NA,
故答案为:3.01×1024或者5NA
点评:
本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.
.题目解答
答案
解答:
解:(1)Al元素的化合价升高,失去电子,Al被氧化作还原剂,NaNO3中N元素化合价降低得电子,被还原,
故答案为:Al;失去; N;还原;
(2)反应中Al→AlO2﹣,Al元素化合价由价升高为+3价,共升高3价,NO3﹣→N2↑,氮元素化合价由+5价降低为价,共降低10价,化合价升降最小公倍数为30,故Al的系数为10,N2系数为3,由氮元素守恒可知系数为6,由Al元素守恒可知系数为10,由电荷守恒可知OH﹣系数为4,由H元素守恒可知H2O前面的系数为2,方程式为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,
故答案为:10;6;4;10;3;2;
(3)该反应中只有Al元素失电子化合价升高,Al元素化合价由价变为+3价,所以10molAl完全反应转移电子的物质的量为30mol,则转移电子数为30NA;该反应中Al元素化合价由价变为+3价,N元素化合价由+5价变为价,根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为,
故答案为:;
(4)产生11.2L气体,物质的量为0.5mol,则转移的电子的物质的量为0.5mol×2×(5﹣)=5mol,数目为3.01×1024或者5NA,
故答案为:3.01×1024或者5NA
点评:
本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.
.