题目
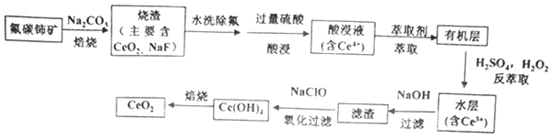
二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:烧渣 水洗除氟 过量硫酸 酸没液 萃取剂 有机层-|||-氟碳饰矿 Na2CO 主要含-|||-焙烧 CeO2,NaF) 酸没 含((c)^4) 萃取-|||-H2SO4,H2O2-|||-CeO2 水层-|||-熔烧 c(OH)4 氧化过滤 滤渣 过滤 (((c)^2)-|||-NaClO NaOH-|||-+ 反萃取已知:①Ce4+能与SO42-结合成[CeSO4]2+;②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。(1)焙烧过程中发生的主要反应方程式为 ____ 。(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+。①实验室中萃取时用到的主要玻璃仪器为烧杯和 ____ 。②如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=(c[Ce•((H)_(2n-4)/(A)_{2n))]}(c(CeS{O)_(4)^2+)})。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因: ____ 。烧渣 水洗除氟 过量硫酸 酸没液 萃取剂 有机层-|||-氟碳饰矿 Na2CO 主要含-|||-焙烧 CeO2,NaF) 酸没 含((c)^4) 萃取-|||-H2SO4,H2O2-|||-CeO2 水层-|||-熔烧 c(OH)4 氧化过滤 滤渣 过滤 (((c)^2)-|||-NaClO NaOH-|||-+ 反萃取③在D=80的条件下,取20mL含四价铈总浓度为0.1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)= ____ 。 (结果保留三位有效数字)(3)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+.H2O2在该反应中作用与下列反应中H2O2的作用相同的是 ____ 。A.H2O2和MnO2混合制O2B.用H2O2处理含酸性K2Cr2O7的废水C.H2O2和CaO混合制备CaO2D.用稀硫酸和H2O2的混合液溶解金属Cu(4)溶液中c(Ce3+)等于1.0×10-5mol•L-1,可认为Ce3+沉淀完全,此时溶液的pH为 ____ ,(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 ____ 。(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为 ____ %;下列选项可能使测定结果偏低的是 ____ 。A.滴定前平视读数,滴定终点时仰视读数B.滴定时锥形瓶内溶液变红就立即停止滴定C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
二氧化铈(CeO2)是一种重要的稀土氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下:
已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为 ____ 。
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和 ____ 。
②如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=$\frac{c[Ce•({H}_{2n-4}{A}_{2n})]}{c(CeS{O}_{4}^{2+})}$)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因: ____ 。
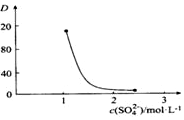
③在D=80的条件下,取20mL含四价铈总浓度为0.1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)= ____ 。 (结果保留三位有效数字)
(3)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+.H2O2在该反应中作用与下列反应中H2O2的作用相同的是 ____ 。
A.H2O2和MnO2混合制O2B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol•L-1,可认为Ce3+沉淀完全,此时溶液的pH为 ____ ,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 ____ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为 ____ %;下列选项可能使测定结果偏低的是 ____ 。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡

已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能。
(1)焙烧过程中发生的主要反应方程式为 ____ 。
(2)“萃取”时存在反应:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+。
①实验室中萃取时用到的主要玻璃仪器为烧杯和 ____ 。
②如图中D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(D=$\frac{c[Ce•({H}_{2n-4}{A}_{2n})]}{c(CeS{O}_{4}^{2+})}$)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因: ____ 。

③在D=80的条件下,取20mL含四价铈总浓度为0.1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2,充分振荡,静置,水层中c(CeSO42+)= ____ 。 (结果保留三位有效数字)
(3)“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+.H2O2在该反应中作用与下列反应中H2O2的作用相同的是 ____ 。
A.H2O2和MnO2混合制O2B.用H2O2处理含酸性K2Cr2O7的废水
C.H2O2和CaO混合制备CaO2D.用稀硫酸和H2O2的混合液溶解金属Cu
(4)溶液中c(Ce3+)等于1.0×10-5mol•L-1,可认为Ce3+沉淀完全,此时溶液的pH为 ____ ,
(已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 ____ 。
(5)取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,则该产品中CeO2的质量分数为 ____ %;下列选项可能使测定结果偏低的是 ____ 。
A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
题目解答
答案
解:(1)氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,焙烧过程中,CeFCO3转化生成CeO2和NaF,焙烧过程Na2CO3、O2参加反应,发生的主要反应方程式为:4CeFCO3+O2+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$4 CeO2+4NaF+6CO2,
故答案为:4CeFCO3+O2+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$4 CeO2+4NaF+6CO2;
(2)①萃取剂能将铈离子从水溶液中萃取出来,实验室进行萃取操作时用到的主要玻璃仪器有:分液漏斗、烧杯,
故答案为:分液漏斗;
②根据平衡:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小,
故答案为:随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小;
③20mL含四价铈总浓度为0.1mol/L的酸浸液,n(Ce4+)=0.002mol,向其中加入10mL萃取剂(HA)2,“萃取”时存在反应:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+,D=$\frac{c[Ce•({H}_{2n-4}{A}_{2n})]}{c(CeS{O}_{4}^{2+})}$)=80,c(CeSO42+)=0.002×$\frac{1}{80+1}$×$\frac{20}{30}$×103mol/L≈2.44×10-3mol/L,
故答案为:2.44×10-3mol/L;
(3)“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,
A.H2O2和MnO2混合制O2,H2O2在该反应中既作氧化剂又作还原剂,故A错误;
B.K2Cr2O7能氧化过氧化氢,用H2O2处理含酸性K2Cr2O7的废水,H2O2在该反应中只作还原剂,故B正确;
C.H2O2和CaO混合制备CaO2,H2O2在该反应中未发生化合价改变,故C错误;
D.用稀硫酸和H2O2的混合液溶解金属Cu,H2O2在该反应中作氧化剂,故D错误;
故答案为:B;
(4)溶液中c(Ce3+)等于1.0×10-5mol•L-1,可认为Ce3+沉淀完全,此时QC≥Ksp[Ce(OH)3]=C(Ce3+)×C3(OH-)=1.0×10-20=1.0×10-5mol•L-1×C3(OH-),解得C(OH-)=1.0×10-5mol•L-1,Kw=c(H+)×c(OH-)=10-14,C(H+)=10-9mol/L,PH=9,“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的离子方程式为2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl-,
故答案为:9;2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl-;
(5)FeSO4的物质的量为amol•L-1×V1×10-3L=aV1×10-3mol,用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,Mn从+7价降为+2价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:MnO4-~~~5Fe2+,则与CeO2反应的硫酸亚铁的物质的量为aV1×10-3mol-5bV2×10-3mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为(aV1×10-3mol-5bV2×10-3mol)×172g/mol=17.2(aV1-5bV2)×10-3g,产品中CeO2的质量分数为$\frac{17.2(a{V}_{1}-5b{V}_{2})}{m}$%,
用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,与CeO2反应的硫酸亚铁的物质的量为aV1×10-3mol-5bV2×10-3mol,
A.滴定前平视读数,终点读数时仰视读数,导致消耗的标准液体积偏大,所测溶液浓度偏高,则该产品中CeO2的质量分数偏低,故A选;
B.滴定时锥形瓶内溶液变红就立即停止滴定,导致消耗的标准液体积偏小,所测溶液浓度偏低,则该产品中CeO2的质量分数偏高,故B不选;
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡,则消耗的标准液偏少,所测溶液浓度偏低,则该产品中CeO2的质量分数偏高,故C不选;
故答案为:$\frac{17.2(a{V}_{1}-5b{V}_{2})}{m}$);A。
故答案为:4CeFCO3+O2+2Na2CO3$\frac{\underline{\;高温\;}}{\;}$4 CeO2+4NaF+6CO2;
(2)①萃取剂能将铈离子从水溶液中萃取出来,实验室进行萃取操作时用到的主要玻璃仪器有:分液漏斗、烧杯,
故答案为:分液漏斗;
②根据平衡:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小,
故答案为:随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D迅速减小;
③20mL含四价铈总浓度为0.1mol/L的酸浸液,n(Ce4+)=0.002mol,向其中加入10mL萃取剂(HA)2,“萃取”时存在反应:Ce4++n(HA)2⇌Ce•(H2n-4A2n)+4H+,D=$\frac{c[Ce•({H}_{2n-4}{A}_{2n})]}{c(CeS{O}_{4}^{2+})}$)=80,c(CeSO42+)=0.002×$\frac{1}{80+1}$×$\frac{20}{30}$×103mol/L≈2.44×10-3mol/L,
故答案为:2.44×10-3mol/L;
(3)“反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,反应的离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+,H2O2在该反应中作还原剂,
A.H2O2和MnO2混合制O2,H2O2在该反应中既作氧化剂又作还原剂,故A错误;
B.K2Cr2O7能氧化过氧化氢,用H2O2处理含酸性K2Cr2O7的废水,H2O2在该反应中只作还原剂,故B正确;
C.H2O2和CaO混合制备CaO2,H2O2在该反应中未发生化合价改变,故C错误;
D.用稀硫酸和H2O2的混合液溶解金属Cu,H2O2在该反应中作氧化剂,故D错误;
故答案为:B;
(4)溶液中c(Ce3+)等于1.0×10-5mol•L-1,可认为Ce3+沉淀完全,此时QC≥Ksp[Ce(OH)3]=C(Ce3+)×C3(OH-)=1.0×10-20=1.0×10-5mol•L-1×C3(OH-),解得C(OH-)=1.0×10-5mol•L-1,Kw=c(H+)×c(OH-)=10-14,C(H+)=10-9mol/L,PH=9,“氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的离子方程式为2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl-,
故答案为:9;2Ce(OH)3+ClO-+H2O=2Ce(OH)4+Cl-;
(5)FeSO4的物质的量为amol•L-1×V1×10-3L=aV1×10-3mol,用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,消耗标准溶液V2mL,Mn从+7价降为+2价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:MnO4-~~~5Fe2+,则与CeO2反应的硫酸亚铁的物质的量为aV1×10-3mol-5bV2×10-3mol,根据电子得失守恒可得关系式CeO2~FeSO4,所以CeO2的质量为(aV1×10-3mol-5bV2×10-3mol)×172g/mol=17.2(aV1-5bV2)×10-3g,产品中CeO2的质量分数为$\frac{17.2(a{V}_{1}-5b{V}_{2})}{m}$%,
用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4,与CeO2反应的硫酸亚铁的物质的量为aV1×10-3mol-5bV2×10-3mol,
A.滴定前平视读数,终点读数时仰视读数,导致消耗的标准液体积偏大,所测溶液浓度偏高,则该产品中CeO2的质量分数偏低,故A选;
B.滴定时锥形瓶内溶液变红就立即停止滴定,导致消耗的标准液体积偏小,所测溶液浓度偏低,则该产品中CeO2的质量分数偏高,故B不选;
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡,则消耗的标准液偏少,所测溶液浓度偏低,则该产品中CeO2的质量分数偏高,故C不选;
故答案为:$\frac{17.2(a{V}_{1}-5b{V}_{2})}{m}$);A。