题目
化学专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl。实验流程如图:NaHCO3-|||-气体-|||-氮 NaClO表 氨 CO2 产品Na2 CO3-|||-母液 NaCl粉末 食盐水-|||-产品NH4Cl回答下列问题:(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是 ____ (按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或 ____ 。NaHCO3-|||-气体-|||-氮 NaClO表 氨 CO2 产品Na2 CO3-|||-母液 NaCl粉末 食盐水-|||-产品NH4Cl(2)B中使用雾化装置的优点是 ____ 。(3)生成NaHCO3的总反应的化学方程式为 ____ 。(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为 ____ g。②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为 ____ 、 ____ 、洗涤、干燥。NaHCO3-|||-气体-|||-氮 NaClO表 氨 CO2 产品Na2 CO3-|||-母液 NaCl粉末 食盐水-|||-产品NH4Cl(5)无水Na2CO3可作为基准物质标定盐酸浓度。称量前,若无水Na2CO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果 ____ (填标号)。A.偏高B.偏低C.不变
化学专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl。实验流程如图:
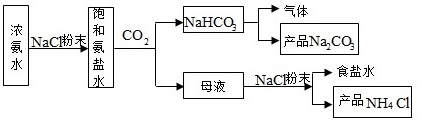
回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是 ____ (按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或 ____ 。
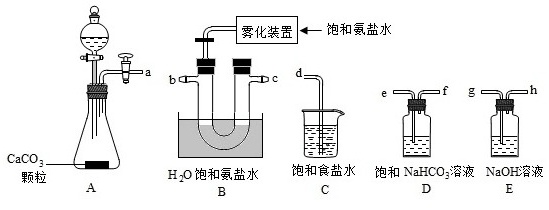
(2)B中使用雾化装置的优点是 ____ 。
(3)生成NaHCO3的总反应的化学方程式为 ____ 。
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为 ____ g。
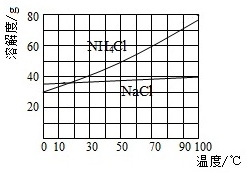
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为 ____ 、 ____ 、洗涤、干燥。
(5)无水Na2CO3可作为基准物质标定盐酸浓度。称量前,若无水Na2CO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果 ____ (填标号)。
A.偏高
B.偏低
C.不变

回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是 ____ (按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或 ____ 。

(2)B中使用雾化装置的优点是 ____ 。
(3)生成NaHCO3的总反应的化学方程式为 ____ 。
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为 ____ g。
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为 ____ 、 ____ 、洗涤、干燥。

(5)无水Na2CO3可作为基准物质标定盐酸浓度。称量前,若无水Na2CO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果 ____ (填标号)。
A.偏高
B.偏低
C.不变
题目解答
答案
解:(1)A装置用于制备CO2气体,由于反应放热,使CO2气体中混有HCl气体,可用饱和NaHCO3溶液除去,洗气装置是导气管长进短出,CO2气体通入盛有饱和氨盐水装置生成NaHCO3,由装置B的水浴可知,该反应放热会使氨盐水的氨气逸出,可用饱和食盐水吸收,一可防止氨气污染空气,而二可得到的氨盐水可循环使用,所以装置的接口连接顺序为:aefbcd;为使A中分液漏斗内的稀盐酸顺利滴下,先平衡分液漏斗内气压,可将分液漏斗上部的玻璃塞打开或凹槽对准小孔,
故答案为:aefbcd;凹槽对准小孔;
(2)B中使用雾化装置,可增大CO2气体与氨盐水的接触面积,加快反应速率,使CO2气体更充分吸收,
故答案为:增大CO2气体与氨盐水的接触面积,加快反应速率;
(3)氨盐水是氨气、NaCl的混合溶液,通入CO2气体生成NaHCO3和NH4Cl,总反应的方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(4)①NaHCO3分解反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,Na2O2吸收CO2反应为2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2→Na2CO3增重相当于Na2O2+CO=Na2CO3,则关系式为2NaHCO3~CO2~Na2O2~“CO“,Na2O2增重0.14g,相当吸收了0.14gCO,n(NaHCO3)=2n(CO)=2×$\frac{m}{M}$=2×$\frac{0.14g}{28g/mol}$=0.01mol,m(NaHCO3)=nM=0.01mol×84g/mol=0.84g,
故答案为:0.84;
②根据NaCl和NH4Cl溶解度曲线可知,从NaCl和NH4Cl混合溶液中分离NH4Cl固体可用冷却结晶方法,再过滤、洗涤、干燥得到NH4Cl固体,
故答案为:冷却;过滤;
(5)若无水Na2CO3保存不当,吸收了一定量水分,会使标准液的物质的量浓度偏低,标定过程中消耗V(Na2CO3)偏大,由c(待测)=$\frac{2c(标准)}{V(待测)}×V(标准)$分析可知,标定的盐酸浓度偏大,
故答案为:A。
故答案为:aefbcd;凹槽对准小孔;
(2)B中使用雾化装置,可增大CO2气体与氨盐水的接触面积,加快反应速率,使CO2气体更充分吸收,
故答案为:增大CO2气体与氨盐水的接触面积,加快反应速率;
(3)氨盐水是氨气、NaCl的混合溶液,通入CO2气体生成NaHCO3和NH4Cl,总反应的方程式为NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl;
(4)①NaHCO3分解反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑,Na2O2吸收CO2反应为2Na2O2+2CO2=2Na2CO3+O2↑,Na2O2→Na2CO3增重相当于Na2O2+CO=Na2CO3,则关系式为2NaHCO3~CO2~Na2O2~“CO“,Na2O2增重0.14g,相当吸收了0.14gCO,n(NaHCO3)=2n(CO)=2×$\frac{m}{M}$=2×$\frac{0.14g}{28g/mol}$=0.01mol,m(NaHCO3)=nM=0.01mol×84g/mol=0.84g,
故答案为:0.84;
②根据NaCl和NH4Cl溶解度曲线可知,从NaCl和NH4Cl混合溶液中分离NH4Cl固体可用冷却结晶方法,再过滤、洗涤、干燥得到NH4Cl固体,
故答案为:冷却;过滤;
(5)若无水Na2CO3保存不当,吸收了一定量水分,会使标准液的物质的量浓度偏低,标定过程中消耗V(Na2CO3)偏大,由c(待测)=$\frac{2c(标准)}{V(待测)}×V(标准)$分析可知,标定的盐酸浓度偏大,
故答案为:A。