绪 论1.1在银催化剂上进行甲醇氧化为甲醛的反应:(H)_(3)OH+(O)_(2)arrow 2HCHO+2(H)_(2)O(H)_(3)OH+(O)_(2)arrow 2HCHO+2(H)_(2)O进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算(1)(1) 反应的选择性;(2)(2) 反应器出口气体的组成。
绪 论
1.1在银催化剂上进行甲醇氧化为甲醛的反应:
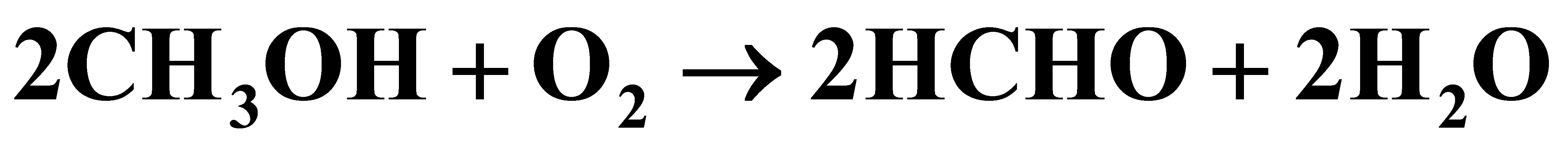
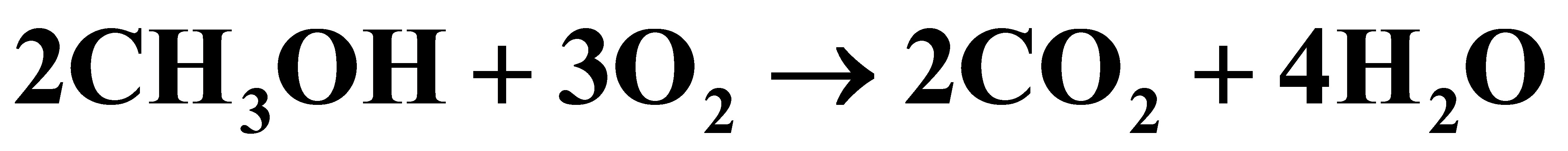
进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。试计算
(1)(1) 反应的选择性;
(2)(2) 反应器出口气体的组成。
题目解答
答案
解:(1)由(1.7)式得反应的选择性为:
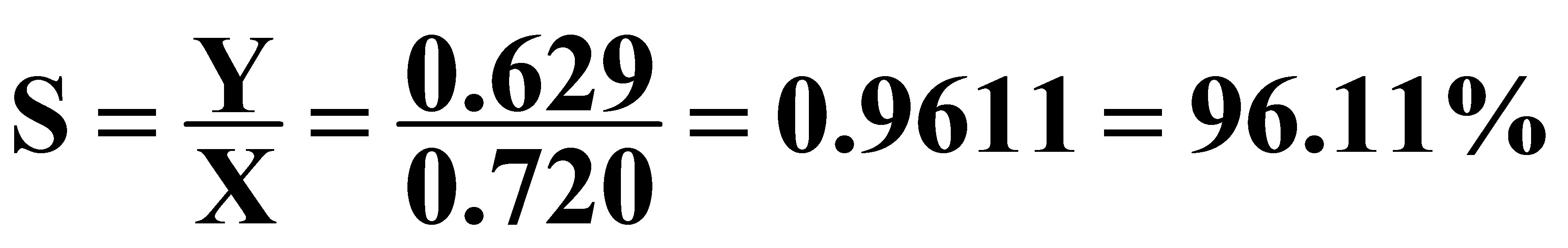
(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为
组分 | 摩尔分率yi0 | 摩尔数ni0(mol) |
CH3OH | 2/(2+4+1.3)=0.2740 | 27.40 |
空气 | 4/(2+4+1.3)=0.5479 | 54.79 |
水 | 1.3/(2+4+1.3)=0.1781 | 17.81 |
总计 | 1.000 | 100.0 |
设甲醇的转化率为XA,甲醛的收率为YP,根据(1.3)和(1.5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
nA=nA0(1-XA)=7.672 mol
nP=nA0YP=18.96 mol
nC=nA0(XA-YP)=0.7672 mol
结合上述反应的化学计量式,水(nW)、氧气(nO)和氮气(nN)的摩尔数分别为:
nW=nW0+nP+2nC=38.30 mol
nO=nO0-1/2nP-3/2nC=0.8788 mol
nN=nN0=43.28 mol
所以,反应器出口气体组成为:
组分 | 摩尔数(mol) | 摩尔分率% |
CH3OH | 7.672 | 6.983 |
HCHO | 18.96 | 17.26 |
H2O | 38.3 | 34.87 |
CO2 | 0.7672 | 0.6983 |
O2 | 0.8788 | 0.7999 |
N2 | 43.28 | 39.39 |
1.1. 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:
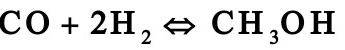
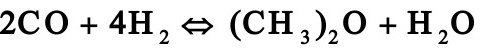
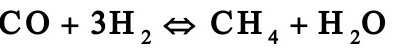
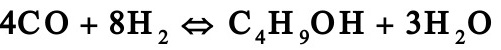

由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。下图是生产流程示意图
t(h) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
CA(mol/l) | 1.40 | 0.90 | 0.61 | 0.40 | 0.28 | 0.17 | 0.12 | 0.08 | 0.045 | 0.03 |
dCA/dt(mol/l.h) | 0.70 | 0.45 | 0.295 | 0.191 | 0.147 | 0.095 | 0.06 | 0.033 | 0.025 | 0.015 |
设为一级不可逆反应,用dCA/dt~CA作图得一直线,其斜率为0.5h-1,其动力学方程可表示为:
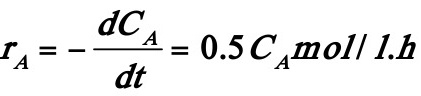
或将速率方程直线化,即两边取对数,得:
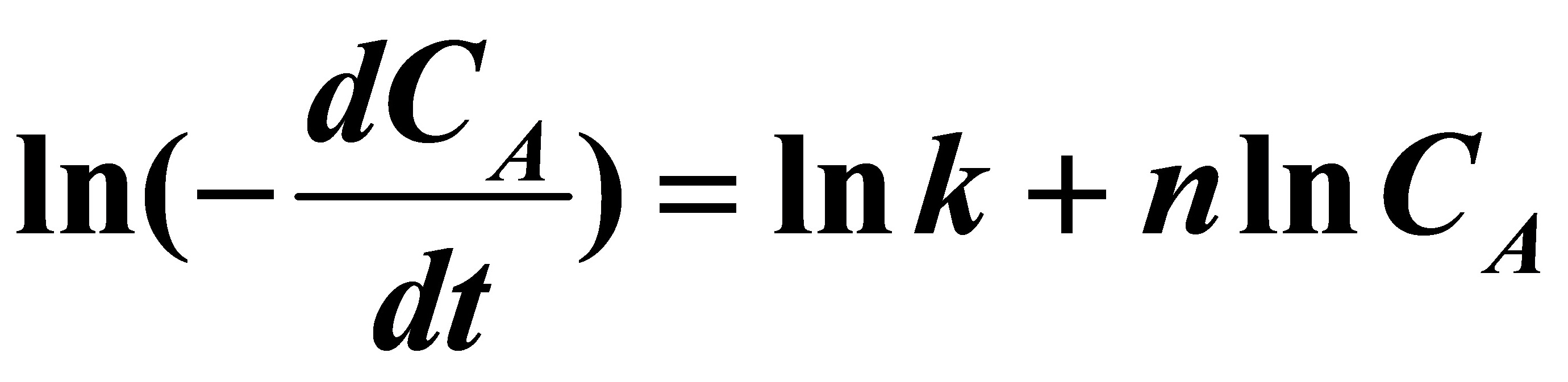
可简化为y=b+ax形式,利用多元回归,可求得反应级数n=1.004≈1,反应速率常数值为k=0.4996。
还可用一数学公式来拟合CA~t曲线,然后再将该数学公式对t求导,求得dCA/dt之值,此法会比作图法来的准确。
2.19在Ni催化剂上进行甲烷化反应:
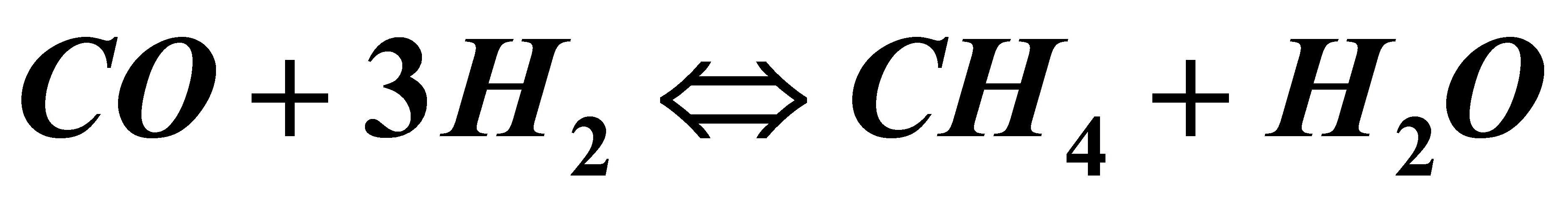
由实验测得200℃时甲烷的生成速率RCH4及CO和H2的分压pCO,pH 2的关系如下:
pCO(MPa) | 0.10 | 0.18 | 0.408 | 0.72 | 1.05 |
pH2(MPa) | 0.1013 | 0.1013 | 0.1013 | 0.1013 | 0.1013 |
RCH4 |
若该反应的动力学方程可用幂函数表示,试用最小二乘法求一氧化碳的反应级数及正反应速率常数。
解:由题意可写出速率方程式:
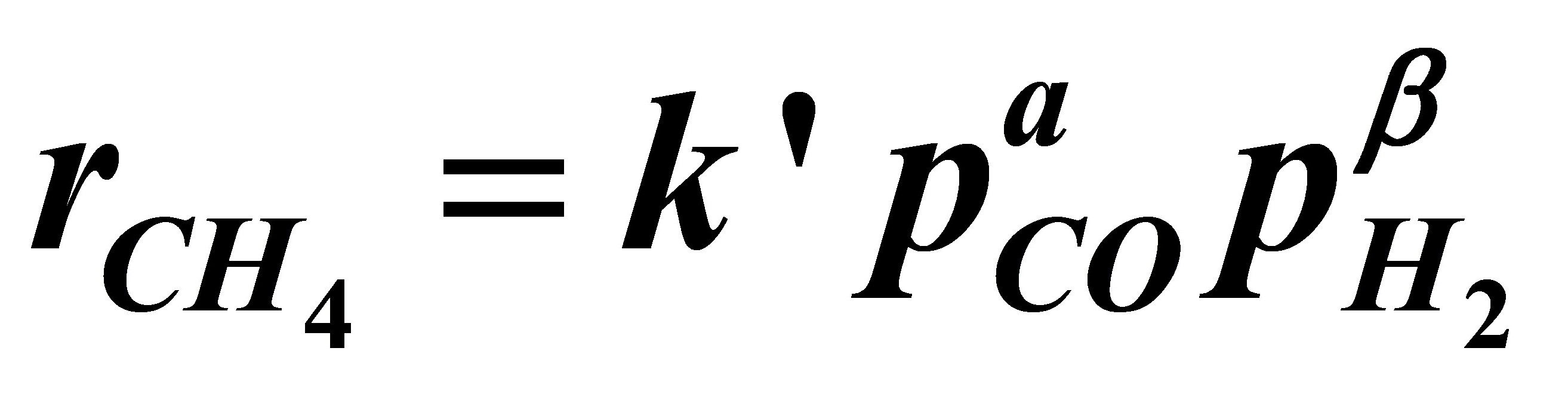
但由于氢的分压保持为0.1013MPa的恒定值,反应速率式可简化为:
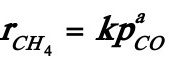
式中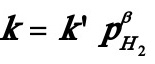 。将速率式直线化:
。将速率式直线化:
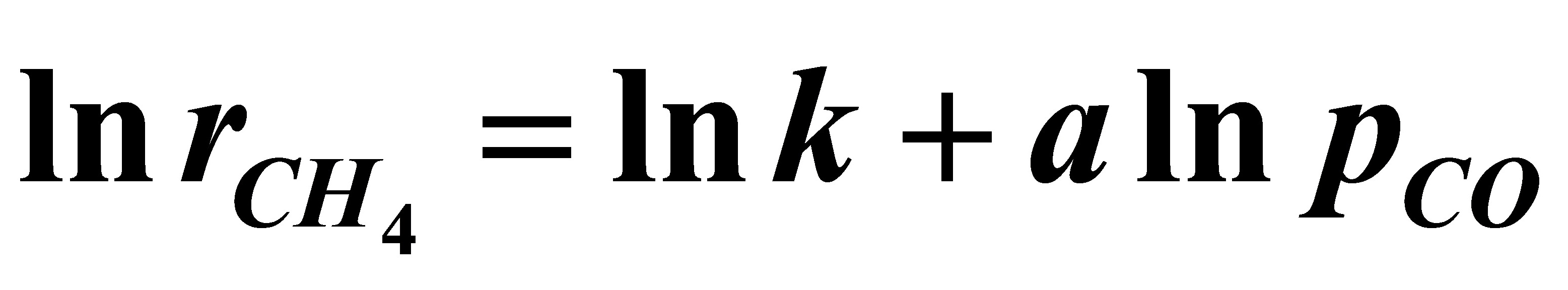 或
或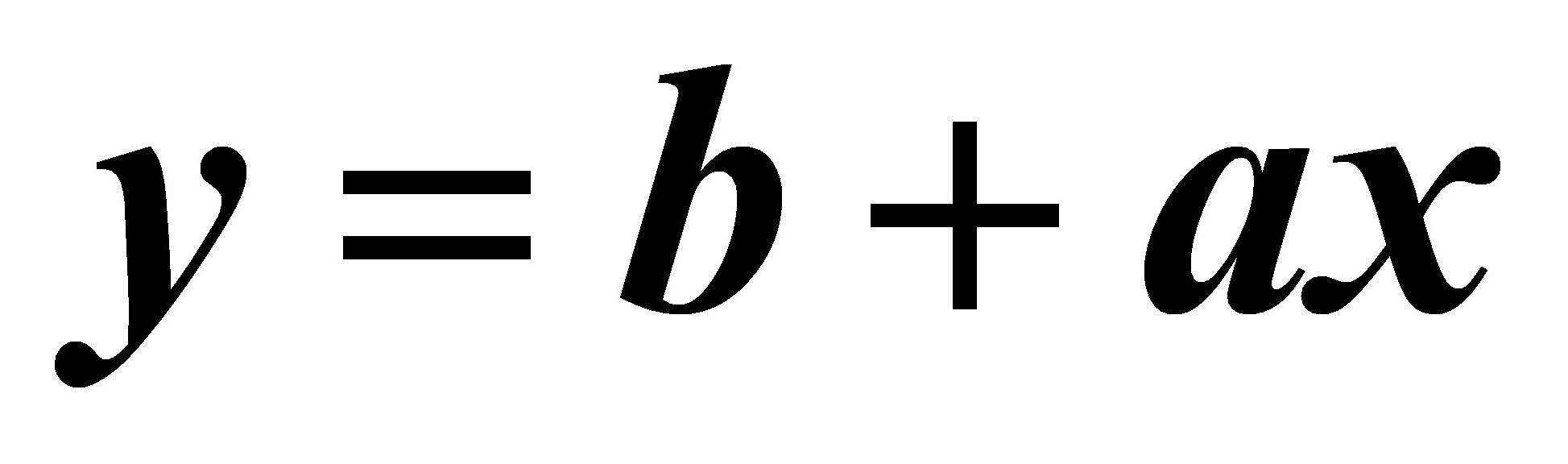
式中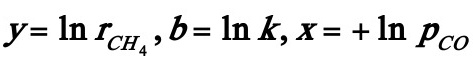 ,由残差平方和最小而导出最小二乘法的系数计算式:
,由残差平方和最小而导出最小二乘法的系数计算式:
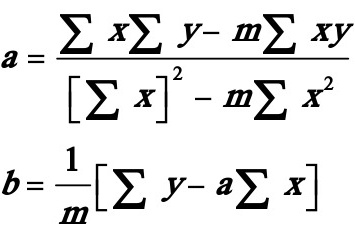
序号 | y | x | x2 | xy |
1 | -4.916 | -2.303 | 5.302 | 11.32 |
2 | -4.328 | -1.715 | 2.941 | 7.421 |
3 | -3.507 | -0.897 | 0.804 | 3.144 |
4 | -2.941 | -0.329 | 0.108 | 0.966 |
5 | -2.564 | -0.049 | 0.002 | -0.125 |
∑ | -18.26 | -5.293 | 9.157 | 22.73 |
将累加值代入a,b系数式中,得:
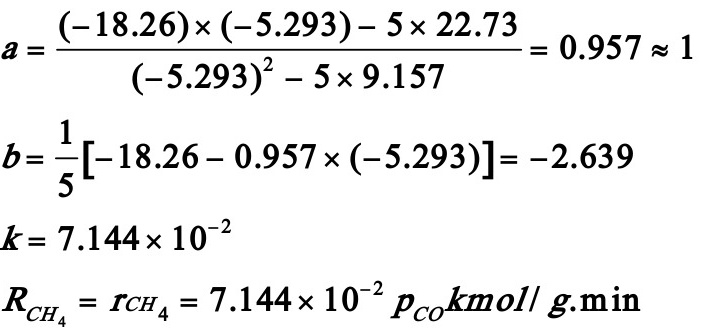
2.20在铂催化剂上,乙烯深度氧化的动力学方程可表示为:
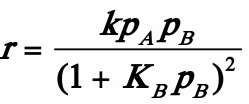
式中pA,pB分别表示乙烯及氧的分压。在473K等温下的实验数据如下:
号 | pA×103MPa | pB×103MPa | r×104mol/g.min |
1 | 8.990 | 3.230 | 0.672 |
2 | 14.22 | 3.000 | 1.072 |
3 | 8.860 | 4.080 | 0.598 |
4 | 8.320 | 2.030 | 0.713 |
5 | 4.370 | 0.890 | 0.610 |
6 | 7.750 | 1.740 | 0.834 |
7 | 7.750 | 1.820 | 0.828 |
8 | 6.170 | 1.730 | 0.656 |
9 | 6.130 | 1.730 | 0.694 |
10 | 6.980 | 1.560 | 0.791 |
11 | 2.870 | 1.060 | 0.418 |
试求该温度下的反应速率常数k和吸附平衡常数KB。
解:首先将动力学方程式直线化:
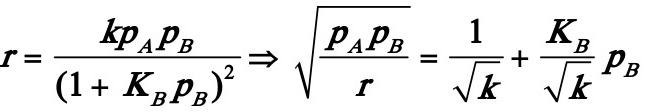
或y=b+ax。其中
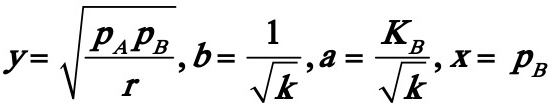
序号 | y | x×103 | x2×105 | xy×103 | r〞×104 | δ,% |
1 | 0.657 | 3.320 | 1.043 | 2.123 | 0.678 | 0.90 |
2 | 0.631 | 3.000 | 0.900 | 1.892 | 1.126 | 5.0 |
3 | 0.778 | 4.080 | 1.665 | 3.172 | 0.568 | 5.0 |
4 | 0.487 | 2.020 | 0.412 | 0.988 | 0.829 | 16.3 |
5 | 0.253 | 0.890 | 0.079 | 0.225 | 0.582 | 4.6 |
6 | 0.402 | 1.740 | 0.303 | 0.700 | 0.833 | 0.1 |
7 | 0.413 | 1.820 | 0.331 | 0.751 | 0.816 | 1.4 |
8 | 0.403 | 1.730 | 0.299 | 0.698 | 0.665 | 1.4 |
9 | 0.391 | 1.730 | 0.299 | 0.676 | 0.661 | 4.8 |
10 | 0.371 | 1.560 | 0.243 | 0.579 | 0.787 | 0.5 |
11 | 0.270 | 1.060 | 0.112 | 0.286 | 0.369 | 11.7 |
∑ | 5.056 | 22.87 | 5.668 | 12.09 |
|
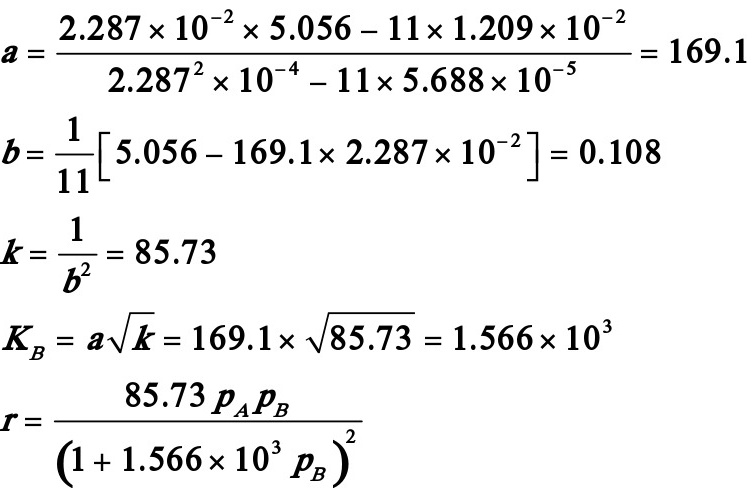
平均偏差 ,结果是令人满意的。
,结果是令人满意的。