题目
6.在上题的条件下,如把1mol液氨放入一真空瓶中,使其等温蒸发,当液氨全部气-|||-化后,瓶内的压力恰为146,921kPa,求此过程的Q W、 △U。-|||-5.液氮在146.921kPa -(25.7)^circ C 气化,气化热为 .86kJcdot mo(l)^-1, 计算1mol液氨在-|||-此条件下气化时所做的功及内能的改变值。 .921kPa,-(25.7)^circ C 时,液氨的比容是-|||-https:/img.zuoyebang.cc/zyb_d19362949bd93d4e0fbabce07adfc33d.jpg.489(cm)^3cdot (g)^-1, 气氨的比容是 .6(cm)^3cdot (g)^-1

题目解答
答案
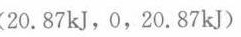
解析
步骤 1:计算液氨和气氨的体积
- 液氨的摩尔质量为 $17.03\,g\cdot mol^{-1}$,因此1mol液氨的质量为 $17.03\,g$。
- 液氨的比容为 $1.489\,cm^{3}\cdot g^{-1}$,因此1mol液氨的体积为 $17.03\,g \times 1.489\,cm^{3}\cdot g^{-1} = 25.37\,cm^{3}$。
- 气氨的比容为 $797.6\,cm^{3}\cdot g^{-1}$,因此1mol气氨的体积为 $17.03\,g \times 797.6\,cm^{3}\cdot g^{-1} = 13585.6\,cm^{3}$。
步骤 2:计算气化过程所做的功
- 气化过程所做的功为 $W = -P\Delta V$,其中 $P$ 为气化时的压力,$\Delta V$ 为体积变化。
- 体积变化 $\Delta V = 13585.6\,cm^{3} - 25.37\,cm^{3} = 13560.23\,cm^{3} = 13.56\,L$。
- 压力 $P = 146.921\,kPa$。
- 因此,所做的功为 $W = -146.921\,kPa \times 13.56\,L = -1993.4\,J = -1.993\,kJ$。
步骤 3:计算内能的改变值
- 根据热力学第一定律,$\Delta U = Q + W$,其中 $Q$ 为气化热,$W$ 为所做的功。
- 气化热 $Q = 22.86\,kJ$。
- 所做的功 $W = -1.993\,kJ$。
- 因此,内能的改变值为 $\Delta U = 22.86\,kJ - 1.993\,kJ = 20.87\,kJ$。
- 液氨的摩尔质量为 $17.03\,g\cdot mol^{-1}$,因此1mol液氨的质量为 $17.03\,g$。
- 液氨的比容为 $1.489\,cm^{3}\cdot g^{-1}$,因此1mol液氨的体积为 $17.03\,g \times 1.489\,cm^{3}\cdot g^{-1} = 25.37\,cm^{3}$。
- 气氨的比容为 $797.6\,cm^{3}\cdot g^{-1}$,因此1mol气氨的体积为 $17.03\,g \times 797.6\,cm^{3}\cdot g^{-1} = 13585.6\,cm^{3}$。
步骤 2:计算气化过程所做的功
- 气化过程所做的功为 $W = -P\Delta V$,其中 $P$ 为气化时的压力,$\Delta V$ 为体积变化。
- 体积变化 $\Delta V = 13585.6\,cm^{3} - 25.37\,cm^{3} = 13560.23\,cm^{3} = 13.56\,L$。
- 压力 $P = 146.921\,kPa$。
- 因此,所做的功为 $W = -146.921\,kPa \times 13.56\,L = -1993.4\,J = -1.993\,kJ$。
步骤 3:计算内能的改变值
- 根据热力学第一定律,$\Delta U = Q + W$,其中 $Q$ 为气化热,$W$ 为所做的功。
- 气化热 $Q = 22.86\,kJ$。
- 所做的功 $W = -1.993\,kJ$。
- 因此,内能的改变值为 $\Delta U = 22.86\,kJ - 1.993\,kJ = 20.87\,kJ$。