题目
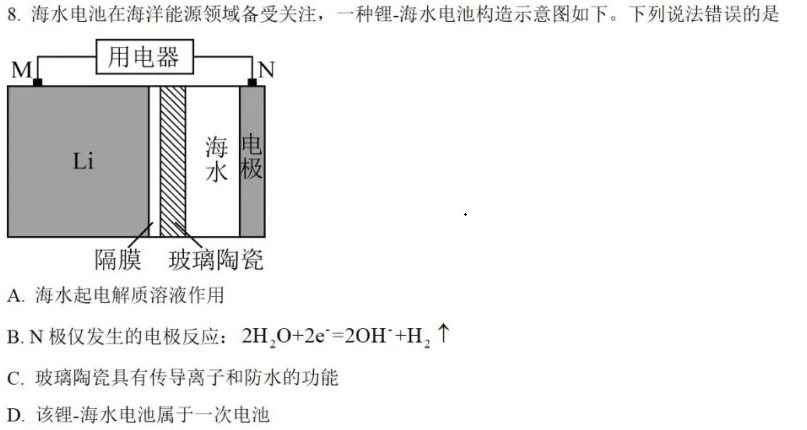
8.海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是-|||-M 用电器 N-|||-Li 海 电-|||-隔膜 玻璃陶瓷-|||-A.海水起电解质溶液作用-|||-B.N极仅发生的电极反应: (H)_(2)O+2(e)^-=2(OH)^-+(H)_(2)uparrow -|||-C.玻璃陶瓷具有传导离子和防水的功能-|||-D.该锂-海水电池属于一次电池
题目解答
答案

解析
步骤 1:确定电池的总反应
锂-海水电池的总反应为 $2Li+2{H}_{2}O=2LiOH+{H}_{2}\uparrow$。该反应表明锂金属与水反应生成氢氧化锂和氢气。
步骤 2:确定电极反应
M极上Li失去电子发生氧化反应,电极反应为 $Li-{e}^{-}={Li}^{+}$,因此M电极为负极。N极上水分子获得电子发生还原反应,电极反应为 $2{H}_{2}O+2{e}^{-}=2{OH}^{-}+{H}_{2}\uparrow$,因此N电极为正极。
步骤 3:分析玻璃陶瓷的作用
玻璃陶瓷的作用是防止水和Li反应,但不能传导离子。如果玻璃陶瓷能传导离子,那么锂离子会直接通过玻璃陶瓷到达正极,导致电池无法正常工作。
步骤 4:确定电池类型
该电池不可充电,属于一次电池。一次电池在使用过程中,电极材料和电解质会逐渐消耗,无法通过充电恢复到初始状态。
锂-海水电池的总反应为 $2Li+2{H}_{2}O=2LiOH+{H}_{2}\uparrow$。该反应表明锂金属与水反应生成氢氧化锂和氢气。
步骤 2:确定电极反应
M极上Li失去电子发生氧化反应,电极反应为 $Li-{e}^{-}={Li}^{+}$,因此M电极为负极。N极上水分子获得电子发生还原反应,电极反应为 $2{H}_{2}O+2{e}^{-}=2{OH}^{-}+{H}_{2}\uparrow$,因此N电极为正极。
步骤 3:分析玻璃陶瓷的作用
玻璃陶瓷的作用是防止水和Li反应,但不能传导离子。如果玻璃陶瓷能传导离子,那么锂离子会直接通过玻璃陶瓷到达正极,导致电池无法正常工作。
步骤 4:确定电池类型
该电池不可充电,属于一次电池。一次电池在使用过程中,电极材料和电解质会逐渐消耗,无法通过充电恢复到初始状态。