题目
0.10-|||-overrightarrow (O) 0.05- .-|||-M N-|||-0 +-|||-5 10 15 20-|||-.(HCOOH)/mI .常温下Ka(HCOOH)=1.8×10-4向20mL0.10mol•L-1NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )A. 水的电离程度:M<NB. M点:2c(OH-)=c(Na+)+c(H+)C. 当V(HCOOH)=10mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)D. N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
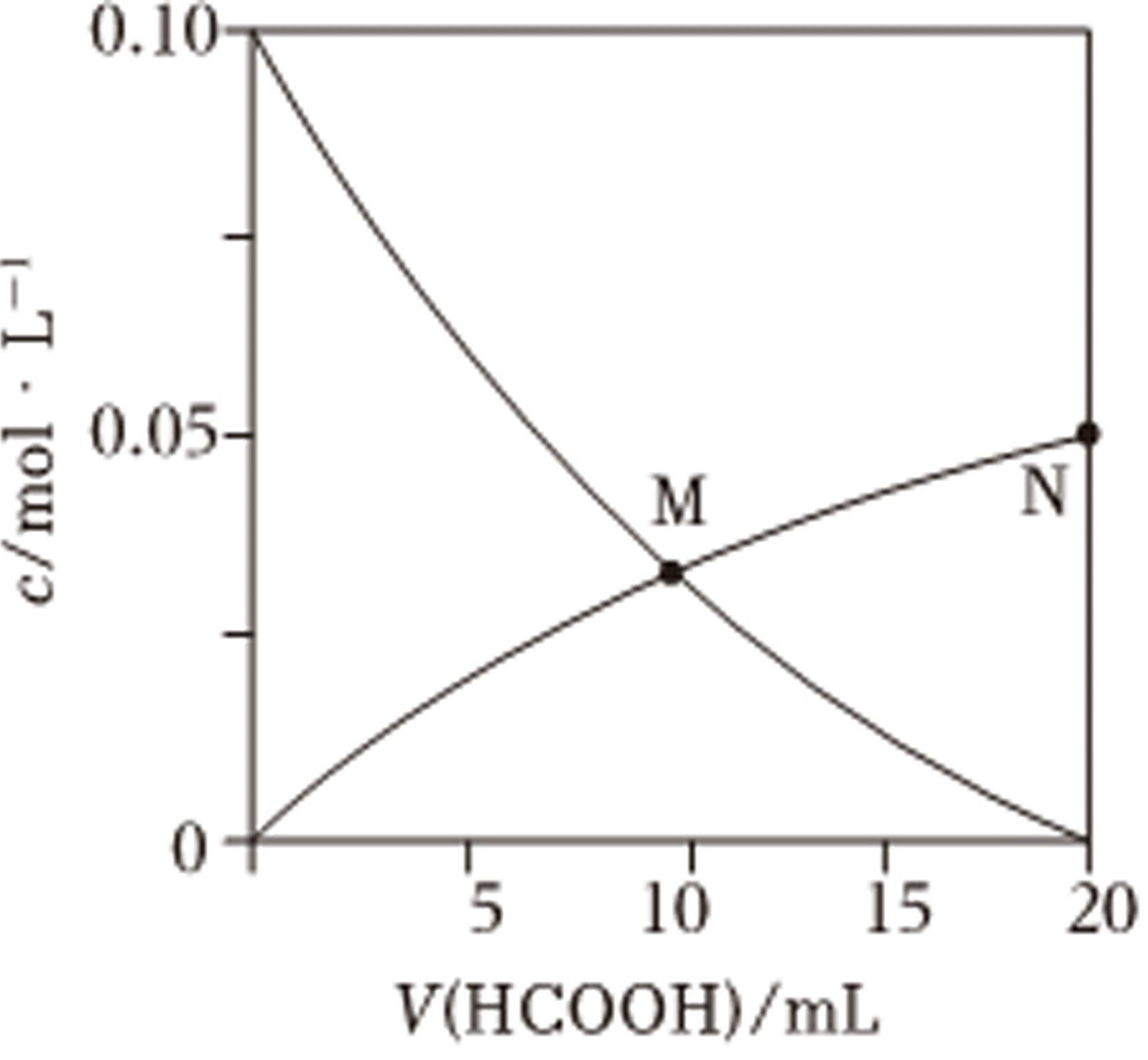 常温下Ka(HCOOH)=1.8×10-4向20mL0.10mol•L-1NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )
常温下Ka(HCOOH)=1.8×10-4向20mL0.10mol•L-1NaOH溶液中缓慢滴入相同浓度的HCOOH溶液,混合溶液中某两种离子的浓度随加入HCOOH溶液体积的变化关系如图所示,下列说法错误的是( )- A. 水的电离程度:M<N
- B. M点:2c(OH-)=c(Na+)+c(H+)
- C. 当V(HCOOH)=10mL时,c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-)
- D. N点:c(Na+)>c(HCOO-)>c(OH-)>c(H+)>c(HCOOH)
题目解答
答案
解:A.M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO-)=1:1,仍剩余有未反应的甲酸,对水的电离是抑制的,N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,此时仅存在HCOONa的水解,此时水的电离程度最大,故A正确;
B.M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO)=1:1,根据电荷守恒有c(Na+)+c(H+)=c(HCOO-)+c(OH-),M点为交点可知c(HCOO-)=c(OH-),联合可得2c(OH-)=c(Na+)+c(H+),故B正确;
C.当v(HCOOH)=10mL时,溶液中的溶质为c(NaOH):C(HCOONa)=1:1,根据电荷守恒有c(Na+)+c(H+)=c(HCOO-)+c(OH-),根据物料守恒c(Na+)=2c(HCOO-)+2c(HCOOH),联合可得c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-),故C正确;
D.N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,甲酸根发生水解,因此c(Na+)>c(HCOO-)及c(OH-)>c(H+),观察图中N点可知,c(HCOO-)≈0.05mol/L,根据Ka(HCOOH)=$\frac{c({H}^{+})×c(HCO{O}^{-})}{c(HCOOH)}$=1.8×10-4,可知c(HCOOH)>c(H+),故D错误;
故选:D。
B.M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO)=1:1,根据电荷守恒有c(Na+)+c(H+)=c(HCOO-)+c(OH-),M点为交点可知c(HCOO-)=c(OH-),联合可得2c(OH-)=c(Na+)+c(H+),故B正确;
C.当v(HCOOH)=10mL时,溶液中的溶质为c(NaOH):C(HCOONa)=1:1,根据电荷守恒有c(Na+)+c(H+)=c(HCOO-)+c(OH-),根据物料守恒c(Na+)=2c(HCOO-)+2c(HCOOH),联合可得c(OH-)=c(H+)+2c(HCOOH)+c(HCOO-),故C正确;
D.N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,甲酸根发生水解,因此c(Na+)>c(HCOO-)及c(OH-)>c(H+),观察图中N点可知,c(HCOO-)≈0.05mol/L,根据Ka(HCOOH)=$\frac{c({H}^{+})×c(HCO{O}^{-})}{c(HCOOH)}$=1.8×10-4,可知c(HCOOH)>c(H+),故D错误;
故选:D。
解析
步骤 1:分析水的电离程度
M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO^{-})=1:1,仍剩余有未反应的甲酸,对水的电离是抑制的。N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,此时仅存在HCOONa的水解,此时水的电离程度最大。因此,水的电离程度:M<N。
步骤 2:分析M点的电荷守恒
M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO^{-})=1:1,根据电荷守恒有c(Na^{+})+c(H^{+})=c(HCOO^{-})+c(OH^{-}),M点为交点可知c(HCOO^{-})=c(OH^{-}),联合可得2c(OH^{-})=c(Na^{+})+c(H^{+})。
步骤 3:分析V(HCOOH)=10mL时的电荷守恒和物料守恒
当v(HCOOH)=10mL时,溶液中的溶质为c(NaOH):C(HCOONa)=1:1,根据电荷守恒有c(Na^{+})+c(H^{+})=c(HCOO^{-})+c(OH^{-}),根据物料守恒c(Na^{+})=2c(HCOO^{-})+2c(HCOOH),联合可得c(OH^{-})=c(H^{+})+2c(HCOOH)+c(HCOO^{-})。
步骤 4:分析N点的离子浓度关系
N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,甲酸根发生水解,因此c(Na^{+})>c(HCOO^{-})及c(OH^{-})>c(H^{+}),观察图中N点可知,c(HCOO^{-})≈0.05mol/L,根据K_a(HCOOH)=$\frac{c({H}^{+})×c(HCO{O}^{-})}{c(HCOOH)}$=1.8×10^{-4},可知c(HCOOH)>c(H^{+})。
M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO^{-})=1:1,仍剩余有未反应的甲酸,对水的电离是抑制的。N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,此时仅存在HCOONa的水解,此时水的电离程度最大。因此,水的电离程度:M<N。
步骤 2:分析M点的电荷守恒
M点时,V(HCOOH)=10mL,溶液中的溶质为c(HCOOH):C(HCOO^{-})=1:1,根据电荷守恒有c(Na^{+})+c(H^{+})=c(HCOO^{-})+c(OH^{-}),M点为交点可知c(HCOO^{-})=c(OH^{-}),联合可得2c(OH^{-})=c(Na^{+})+c(H^{+})。
步骤 3:分析V(HCOOH)=10mL时的电荷守恒和物料守恒
当v(HCOOH)=10mL时,溶液中的溶质为c(NaOH):C(HCOONa)=1:1,根据电荷守恒有c(Na^{+})+c(H^{+})=c(HCOO^{-})+c(OH^{-}),根据物料守恒c(Na^{+})=2c(HCOO^{-})+2c(HCOOH),联合可得c(OH^{-})=c(H^{+})+2c(HCOOH)+c(HCOO^{-})。
步骤 4:分析N点的离子浓度关系
N点HCOOH溶液与NaOH溶液恰好反应生成HCOONa,甲酸根发生水解,因此c(Na^{+})>c(HCOO^{-})及c(OH^{-})>c(H^{+}),观察图中N点可知,c(HCOO^{-})≈0.05mol/L,根据K_a(HCOOH)=$\frac{c({H}^{+})×c(HCO{O}^{-})}{c(HCOOH)}$=1.8×10^{-4},可知c(HCOOH)>c(H^{+})。