题目
已知水在293K时的表面张力 =0.07275Ncdot (m)^-1, 摩尔质量 M=0.018-|||-_(g)cdot (mol)^-1, 密度 rho =(10)^3kgcdot (m)^-3 273K时,水的饱和蒸气压为610.5Pa,在 sim -|||-293K温度区间水的摩尔气化热 (Delta )_(vap)(H)_(m)=40.67kJcdot (mol)^-1, 求293K,水滴半径 r=-|||-^-9m 时水的饱和蒸气压。

题目解答
答案
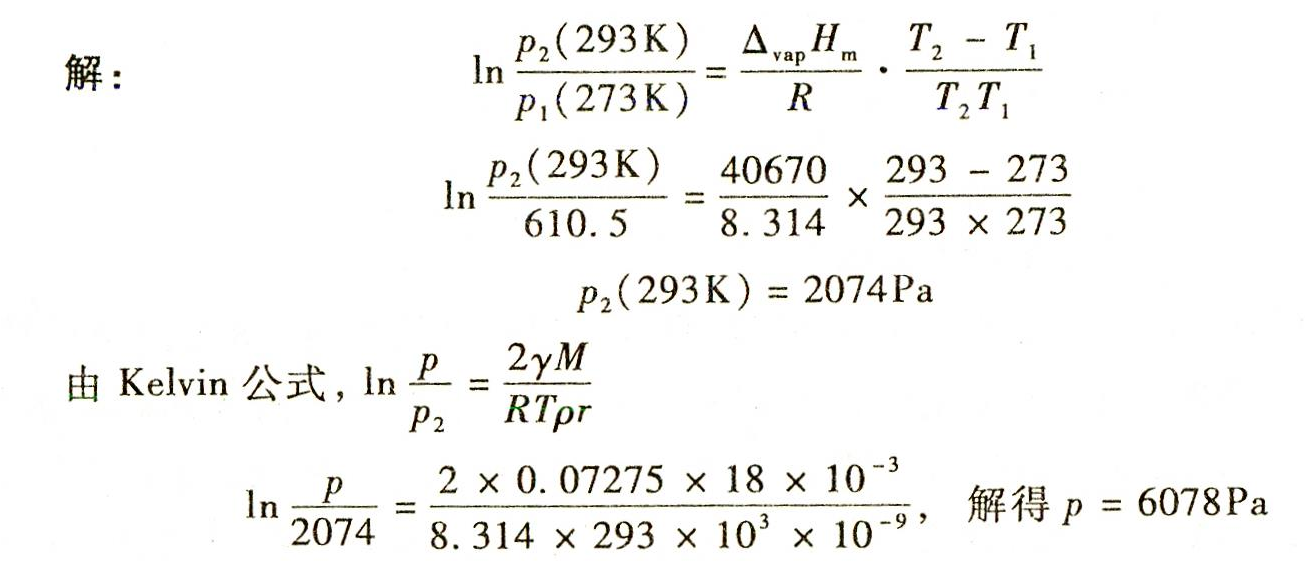
解析
步骤 1:计算293K时水的饱和蒸气压
根据克劳修斯-克拉佩龙方程,可以计算出293K时水的饱和蒸气压。克劳修斯-克拉佩龙方程为:
$\ln \dfrac {{P}_{2}(293K)}{{P}_{1}(273K)}=\dfrac {\Delta moH}{R}\cdot \dfrac {{T}_{2}-{T}_{1}}{{T}_{2}{T}_{1}}$
其中,${P}_{1}(273K)$ 是273K时水的饱和蒸气压,${P}_{2}(293K)$ 是293K时水的饱和蒸气压,$\Delta moH$ 是摩尔气化热,R 是理想气体常数,${T}_{1}$ 和 ${T}_{2}$ 分别是273K和293K的温度。
步骤 2:计算293K时水滴的饱和蒸气压
根据Kelvin公式,可以计算出293K时水滴的饱和蒸气压。Kelvin公式为:
$\ln \dfrac {p}{{p}_{2}}=\dfrac {2vM}{RTp{r}_{p}}$
其中,$p$ 是水滴的饱和蒸气压,${p}_{2}$ 是293K时水的饱和蒸气压,$v$ 是表面张力,M 是摩尔质量,R 是理想气体常数,T 是温度,${r}_{p}$ 是水滴的半径。
根据克劳修斯-克拉佩龙方程,可以计算出293K时水的饱和蒸气压。克劳修斯-克拉佩龙方程为:
$\ln \dfrac {{P}_{2}(293K)}{{P}_{1}(273K)}=\dfrac {\Delta moH}{R}\cdot \dfrac {{T}_{2}-{T}_{1}}{{T}_{2}{T}_{1}}$
其中,${P}_{1}(273K)$ 是273K时水的饱和蒸气压,${P}_{2}(293K)$ 是293K时水的饱和蒸气压,$\Delta moH$ 是摩尔气化热,R 是理想气体常数,${T}_{1}$ 和 ${T}_{2}$ 分别是273K和293K的温度。
步骤 2:计算293K时水滴的饱和蒸气压
根据Kelvin公式,可以计算出293K时水滴的饱和蒸气压。Kelvin公式为:
$\ln \dfrac {p}{{p}_{2}}=\dfrac {2vM}{RTp{r}_{p}}$
其中,$p$ 是水滴的饱和蒸气压,${p}_{2}$ 是293K时水的饱和蒸气压,$v$ 是表面张力,M 是摩尔质量,R 是理想气体常数,T 是温度,${r}_{p}$ 是水滴的半径。