题目
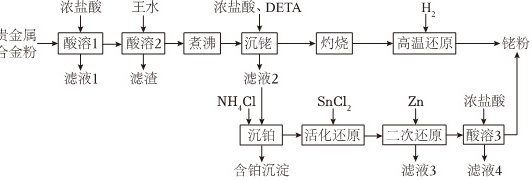
一种从预处理得到的贵金属合金粉[主要成分为Fe、Rh(铑)、Pt,含有少量SiO2]中尽可能回收铑的工艺流程如图:浓盐酸 王水 浓盐酸、 DETA H-|||-贵金属-|||-合金粉 → 酸溶1 → 酸溶2 → 煮沸 → 沉 Y → 灼烧 → 高温还原-|||-滤液1 滤渣 滤液2-|||-NH4Cl SnCl2 Zn 浓盐酸-|||-沉铂 → 活化还原 →二 二次还原 → 酸溶3-|||-含铂沉淀 滤液3 滤液4回答下列问题:(1)“酸溶1”的目的是 ____ 。(2)已知“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为 ____ ;“滤渣”的主要成分是 ____ (填化学式)。(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh2O3和RhCl3,则“高温还原”中发生反应的化学方程式为 ____ 。(4)若“活化还原”在室温下进行,SnCl2初始浓度为1.0×10-4mol•L-1,为避免生成Sn(OH)2沉淀,溶液适宜的pH为 ____ (填标号)[已知Sn(OH)2的Ksp=5.5×10-28]。A.2.0B.4.0C.6.0(5)“活化还原”中,SnCl2必须过量,其与Rh(Ⅲ)反应可生成[Rh(SnCl3)5]4-,提升了Rh的还原速率,该配离子中Rh的化合价为 ____ ;反应中同时生成[SnCl6]2-,Rh(Ⅲ)以[RhCl6]3-计,则理论上SnCl2和Rh(Ⅲ)反应的物质的量之比为 ____ 。(6)“酸溶3”的目的是 ____ 。
一种从预处理得到的贵金属合金粉[主要成分为Fe、Rh(铑)、Pt,含有少量SiO2]中尽可能回收铑的工艺流程如图:
回答下列问题:
(1)“酸溶1”的目的是 ____ 。
(2)已知“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为 ____ ;“滤渣”的主要成分是 ____ (填化学式)。
(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh2O3和RhCl3,则“高温还原”中发生反应的化学方程式为 ____ 。
(4)若“活化还原”在室温下进行,SnCl2初始浓度为1.0×10-4mol•L-1,为避免生成Sn(OH)2沉淀,溶液适宜的pH为 ____ (填标号)[已知Sn(OH)2的Ksp=5.5×10-28]。
A.2.0
B.4.0
C.6.0
(5)“活化还原”中,SnCl2必须过量,其与Rh(Ⅲ)反应可生成[Rh(SnCl3)5]4-,提升了Rh的还原速率,该配离子中Rh的化合价为 ____ ;反应中同时生成[SnCl6]2-,Rh(Ⅲ)以[RhCl6]3-计,则理论上SnCl2和Rh(Ⅲ)反应的物质的量之比为 ____ 。
(6)“酸溶3”的目的是 ____ 。

回答下列问题:
(1)“酸溶1”的目的是 ____ 。
(2)已知“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为 ____ ;“滤渣”的主要成分是 ____ (填化学式)。
(3)“沉铑”中得到的沉淀经“灼烧”后分解成铑单质,但夹杂少量Rh2O3和RhCl3,则“高温还原”中发生反应的化学方程式为 ____ 。
(4)若“活化还原”在室温下进行,SnCl2初始浓度为1.0×10-4mol•L-1,为避免生成Sn(OH)2沉淀,溶液适宜的pH为 ____ (填标号)[已知Sn(OH)2的Ksp=5.5×10-28]。
A.2.0
B.4.0
C.6.0
(5)“活化还原”中,SnCl2必须过量,其与Rh(Ⅲ)反应可生成[Rh(SnCl3)5]4-,提升了Rh的还原速率,该配离子中Rh的化合价为 ____ ;反应中同时生成[SnCl6]2-,Rh(Ⅲ)以[RhCl6]3-计,则理论上SnCl2和Rh(Ⅲ)反应的物质的量之比为 ____ 。
(6)“酸溶3”的目的是 ____ 。
题目解答
答案
(1)根据流程图,原料中的Fe会与盐酸反应,进入溶液中,通过过滤分离,故“酸溶1”的目的是为了溶解Fe使其进入溶液中,通过过滤分离,
故答案为:溶解Fe使其进入溶液中,通过过滤分离;
(2)王水是浓硝酸和浓盐酸按体积比1:3的混合物,可溶解金、铂等金属,根据题目信息,“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为Rh+6HCl+HNO3=H3[RhCl6]+NO↑+2H2O;原料中的SiO2不溶于盐酸、硝酸,故“滤渣”的主要成分是SiO2,
故答案为:Rh+6HCl+HNO3=H3[RhCl6]+NO↑+2H2O;SiO2;
(3)根据题目信息,流程图中“高温还原”中发生的反应是高温下H2将Rh2O3和RhCl3还原为Rh,反应的化学方程式为:Rh2O3+3H2$\frac{\underline{\;高温\;}}{\;}$2Rh+3H2O、2RhCl3+3H2$\frac{\underline{\;高温\;}}{\;}$Rh+6HCl,
故答案为:Rh2O3+3H2$\frac{\underline{\;高温\;}}{\;}$2Rh+3H2O、2RhCl3+3H2$\frac{\underline{\;高温\;}}{\;}$Rh+6HCl;
(4)初始浓度为1.0×10-4mol•L-1的SnCl2溶液,要避免生成Sn(OH)2沉淀,溶液应控制最低pH=14+$\frac{1}{2}$lg$\frac{{K}_{sp}[Sn(OH)_{2}]}{c(S{n}^{2+})}$=14+$\frac{1}{2}$lg$\frac{5.5×1{0}^{-28}}{1×1{0}^{-4}}$=2-lg5.5<2,故溶液适宜的pH为可选2.0,A正确,
故答案为:A;
(5)配离子[Rh(SnCl3)5]4-中,[SnCl3]-带一个负电荷,Sn为+2价,Cl为-1价,设Rh的化合价为x,则有x+(+2-1×3)×5=-4,解得x=+1,即Rh的化合价为+1价;“活化还原”中,SnCl2与Rh(Ⅲ)反应,Rh(Ⅲ)转化为[Rh(SnCl3)5]4-,Rh的化合价从+3变为+1,得2个电子,SnCl2转化为[SnCl6]2-,Sn的化合价从+2变为+4,失2个电子,同时SnCl2与Cl-结合形成[SnCl3]-,生成一个[Rh(SnCl3)5]4-需要5个[SnCl3]-,因此SnCl2和Rh(Ⅲ)反应的物质的量之比为6:1,
故答案为:+1;6:1;
(6)根据流程图,进行二次还原后,Zn与[Rh(SnCl3)5]4-完全反应,滤渣中有Rh、Sn和过量的Zn单质,利用Zn、Sn溶于盐酸而Rh不溶于盐酸的性质,将Rh与Sn、Zn分离,“酸溶3”的目的就是除去Zn和Sn,得到纯净的Rh,
故答案为:除去Zn和Sn,得到纯净的Rh。
故答案为:溶解Fe使其进入溶液中,通过过滤分离;
(2)王水是浓硝酸和浓盐酸按体积比1:3的混合物,可溶解金、铂等金属,根据题目信息,“酸溶2”中Rh转化为H3[RhCl6],则生成该物质的化学方程式为Rh+6HCl+HNO3=H3[RhCl6]+NO↑+2H2O;原料中的SiO2不溶于盐酸、硝酸,故“滤渣”的主要成分是SiO2,
故答案为:Rh+6HCl+HNO3=H3[RhCl6]+NO↑+2H2O;SiO2;
(3)根据题目信息,流程图中“高温还原”中发生的反应是高温下H2将Rh2O3和RhCl3还原为Rh,反应的化学方程式为:Rh2O3+3H2$\frac{\underline{\;高温\;}}{\;}$2Rh+3H2O、2RhCl3+3H2$\frac{\underline{\;高温\;}}{\;}$Rh+6HCl,
故答案为:Rh2O3+3H2$\frac{\underline{\;高温\;}}{\;}$2Rh+3H2O、2RhCl3+3H2$\frac{\underline{\;高温\;}}{\;}$Rh+6HCl;
(4)初始浓度为1.0×10-4mol•L-1的SnCl2溶液,要避免生成Sn(OH)2沉淀,溶液应控制最低pH=14+$\frac{1}{2}$lg$\frac{{K}_{sp}[Sn(OH)_{2}]}{c(S{n}^{2+})}$=14+$\frac{1}{2}$lg$\frac{5.5×1{0}^{-28}}{1×1{0}^{-4}}$=2-lg5.5<2,故溶液适宜的pH为可选2.0,A正确,
故答案为:A;
(5)配离子[Rh(SnCl3)5]4-中,[SnCl3]-带一个负电荷,Sn为+2价,Cl为-1价,设Rh的化合价为x,则有x+(+2-1×3)×5=-4,解得x=+1,即Rh的化合价为+1价;“活化还原”中,SnCl2与Rh(Ⅲ)反应,Rh(Ⅲ)转化为[Rh(SnCl3)5]4-,Rh的化合价从+3变为+1,得2个电子,SnCl2转化为[SnCl6]2-,Sn的化合价从+2变为+4,失2个电子,同时SnCl2与Cl-结合形成[SnCl3]-,生成一个[Rh(SnCl3)5]4-需要5个[SnCl3]-,因此SnCl2和Rh(Ⅲ)反应的物质的量之比为6:1,
故答案为:+1;6:1;
(6)根据流程图,进行二次还原后,Zn与[Rh(SnCl3)5]4-完全反应,滤渣中有Rh、Sn和过量的Zn单质,利用Zn、Sn溶于盐酸而Rh不溶于盐酸的性质,将Rh与Sn、Zn分离,“酸溶3”的目的就是除去Zn和Sn,得到纯净的Rh,
故答案为:除去Zn和Sn,得到纯净的Rh。