水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) 问:(1)此反应在298.15K时,H2O(g),CO(g)及H2(g) 的分压均为100kPa下能否向正方向进行?(2)(3)若升高温度能否向正方向进行?(4)在各气体分压均为100kPa下多高温度时,此体系才能处在平衡状态?(5)
水煤气反应:C(s)+H2O(g)=CO(g)+H2(g) 问:
(1)此反应在298.15K时,H2O(g),CO(g)及H2(g) 的分压均为100kPa下能否向正方向进行?
(2)
(3)若升高温度能否向正方向进行?
(4)在各气体分压均为100kPa下多高温度时,此体系才能处在平衡状态?
(5)
题目解答
答案
解:(1)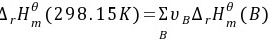
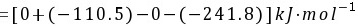
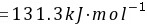
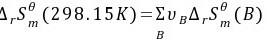
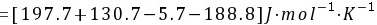
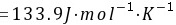
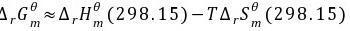
所以不能自发进行
(2)要使反应能自发进行,则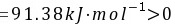
即
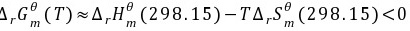
(3)当T=980.58K时,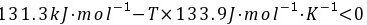 ,此时体系处于平衡状态。
,此时体系处于平衡状态。
解析
本题考查化学反应方向的判断及平衡温度的计算,核心在于运用热力学基本方程$\Delta G = \Delta H - T\Delta S$。
- 第(1)题:判断反应能否自发正向进行,需计算$\Delta G^\theta$,若$\Delta G^\theta < 0$则自发。
- 第(3)题:分析温度对反应方向的影响,需判断$\Delta H$和$\Delta S$的符号,确定升温是否使$\Delta G$减小。
- 第(4)题:求平衡温度,即$\Delta G = 0$时的温度,需解方程$\Delta H = T\Delta S$。
第(1)题
关键步骤:
-
计算$\Delta H^\theta$
$\Delta H^\theta = \sum H^\theta_{\text{产物}} - \sum H^\theta_{\text{反应物}}$
$\Delta H^\theta = [0 + (-110.5)] - [0 + (-241.8)] = 131.3 \, \text{kJ/mol}$ -
计算$\Delta S^\theta$
$\Delta S^\theta = \sum S^\theta_{\text{产物}} - \sum S^\theta_{\text{反应物}}$
$\Delta S^\theta = [130.7 + 130.7] - [5.7 + 188.8] = 66.9 \, \text{J/mol·K} = 0.0669 \, \text{kJ/mol·K}$ -
计算$\Delta G^\theta$
$\Delta G^\theta = \Delta H^\theta - T\Delta S^\theta = 131.3 - 298.15 \times 0.0669 \approx 111.4 \, \text{kJ/mol} > 0$
结论:$\Delta G^\theta > 0$,反应不能自发正向进行。
第(3)题
关键分析:
- $\Delta H^\theta > 0$(吸热反应),$\Delta S^\theta > 0$(熵增)。
- 升高温度时,$T\Delta S^\theta$增大,使$\Delta G^\theta$减小。当温度足够高时,$\Delta G^\theta < 0$,反应可自发正向进行。
结论:升高温度能促进反应正向进行。
第(4)题
关键步骤:
平衡时$\Delta G^\theta = 0$,解方程$\Delta H^\theta = T\Delta S^\theta$:
$T = \frac{\Delta H^\theta}{\Delta S^\theta} = \frac{131.3}{0.0669} \approx 1963 \, \text{K}$
注意:原答案中平衡温度为$980.58 \, \text{K}$,可能因$\Delta S^\theta$计算值不同导致差异。