题目
废旧锂离子电池的正极材料主要成分是LiCoO_(2),还含有少量金属Al、Fe以及其他不溶性物质,采用如图1工艺流程回收其中的钴制备Co单质:NaOH溶液H2SO4 H2O2 氨水 氨水 HCl-|||-废旧电池 碱浸 酸浸 哚 调pH1 调pH2 Co(OH)2 酸溶 电解 Co-|||-极材料-|||-滤液1 滤渣1 滤渣2 滤液2-|||-图1溶液中金属离子开始沉淀和完全沉淀的pH如表所示:金属离子Co^2+Al^3+Fe^3+Fe^2+开始沉淀时(c=0.01 molcdot L^-1)的 pH7.83.72.27.5沉淀完全时(c=1.0times 10-5 molcdot L^-1)的 pH9.34.73.29.0回答下列问题:(1)“滤液1”中主要存在的阴离子有______。(2)“酸浸”中LiCoO_(2)发生反应的化学方程式为______。“酸浸”时需要控制温度在80sim 85^circmathrm(C),温度不宜过高的原因是______。(3)如果“酸浸”后的溶液中Co^2+浓度为1.0molcdot L^-1,则“调pH_(1)”应控制的pH范围是______。(4)“滤液2”中可回收利用的物质主要是______(填化学式)。(5)“酸溶”中发生反应的离子方程式为______。(6)“电解”时装置如图2所示,阴极电极反应式为______,电解后a室中的电解质溶液可以返回______工序循环使用。NaOH溶液H2SO4 H2O2 氨水 氨水 HCl-|||-废旧电池 碱浸 酸浸 哚 调pH1 调pH2 Co(OH)2 酸溶 电解 Co-|||-极材料-|||-滤液1 滤渣1 滤渣2 滤液2-|||-图1
废旧锂离子电池的正极材料主要成分是$LiCoO_{2}$,还含有少量金属$Al$、$Fe$以及其他不溶性物质,采用如图$1$工艺流程回收其中的钴制备$Co$单质:
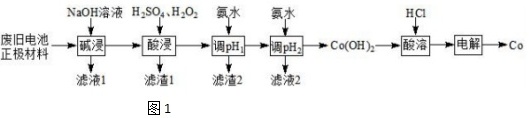
溶液中金属离子开始沉淀和完全沉淀的$pH$如表所示:
回答下列问题:
$(1)$“滤液$1$”中主要存在的阴离子有______。
$(2)$“酸浸”中$LiCoO_{2}$发生反应的化学方程式为______。“酸浸”时需要控制温度在$80\sim 85^{\circ}\mathrm{C}$,温度不宜过高的原因是______。
$(3)$如果“酸浸”后的溶液中$Co^{2+}$浓度为$1.0mol\cdot L^{-1}$,则“调$pH_{1}$”应控制的$pH$范围是______。
$(4)$“滤液$2$”中可回收利用的物质主要是______(填化学式)。
$(5)$“酸溶”中发生反应的离子方程式为______。
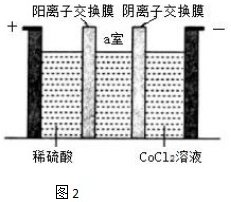
$(6)$“电解”时装置如图$2$所示,阴极电极反应式为______,电解后$a$室中的电解质溶液可以返回______工序循环使用。

溶液中金属离子开始沉淀和完全沉淀的$pH$如表所示:
| 金属离子 | $Co^{2+}$ | $Al^{3+}$ | $Fe^{3+}$ | $Fe^{2+}$ |
| 开始沉淀时$(c=0.01 mol\cdot L^{-1})$的$ pH$ | $7.8$ | $3.7$ | $2.2$ | $7.5$ |
| 沉淀完全时$(c=1.0\times 10-5 mol\cdot L^{-1})$的$ pH$ | $9.3$ | $4.7$ | $3.2$ | $9.0$ |
$(1)$“滤液$1$”中主要存在的阴离子有______。
$(2)$“酸浸”中$LiCoO_{2}$发生反应的化学方程式为______。“酸浸”时需要控制温度在$80\sim 85^{\circ}\mathrm{C}$,温度不宜过高的原因是______。
$(3)$如果“酸浸”后的溶液中$Co^{2+}$浓度为$1.0mol\cdot L^{-1}$,则“调$pH_{1}$”应控制的$pH$范围是______。
$(4)$“滤液$2$”中可回收利用的物质主要是______(填化学式)。
$(5)$“酸溶”中发生反应的离子方程式为______。
$(6)$“电解”时装置如图$2$所示,阴极电极反应式为______,电解后$a$室中的电解质溶液可以返回______工序循环使用。

题目解答
答案
$\left(1\right)Al$和$NaOH$溶液反应生成可溶性的钠盐$NaAlO_{2}$,为了将$Al$尽可能完全除去,所以加入的$NaOH$溶液过量,则“滤液$1$”中主要含有$NaAlO_{2}$、$NaOH$,则主要存在的阴离子有$AlO_{2}^{-}$、$OH^{-}$,
故答案为:$AlO_{2}^{-}$、$OH^{-}$;
$(2)$通过以上分析知,“酸浸”中$LiCoO_{2}$和稀硫酸、双氧水发生反应生成硫酸锂、硫酸钴、氧气和水,该反应中双氧水作还原剂、$LiCoO_{2}$作氧化剂,该反应的化学方程式为$2LiCoO_{2}+3H_{2}SO_{4}+H_{2}O_{2}=Li_{2}SO_{4}+2CoSO_{4}+O_{2}\uparrow +4H_{2}O$,双氧水不稳定,受热易分解,所以“酸浸”时需要控制温度在$80\sim 85^{\circ}\mathrm{C}$,温度不宜过高,
故答案为:$2LiCoO_{2}+3H_{2}SO_{4}+H_{2}O_{2}=Li_{2}SO_{4}+2CoSO_{4}+O_{2}\uparrow +4H_{2}O$;双氧水受热易分解;
$(3)$如果“酸浸”后的溶液中$Co^{2+}$浓度为$1.0mol\cdot L^{-1}$,“调$pH_{1}$”使$Fe^{3+}$完全转化为沉淀但不$Co^{2+}$不转化为沉淀,$Co^{2+}$生成沉淀时$c(OH^{-})=\sqrt{\frac{(\frac{1{0}^{-14}}{1{0}^{-7.8}})^{2}×0.01}{1.0}}mol/L=10^{-7.2}mol/L$,溶液中$c(H^{+})=\frac{1{0}^{-14}}{1{0}^{-7.2}}mol/L=10^{-6.8}mol/L$,溶液的$pH=6.8$,$Fe^{3+}$完全转化为沉淀时溶液的$pH=3.2$,根据表中数据知,应控制的$pH$范围是$3.2 \lt pH \lt 6.8$,
故答案为:$3.2\sim 6.8$;
$(4)$通过以上分析知,“滤液$2$”含有$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$,则“滤液$2$”中可回收利用的物质主要是$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$,
故答案为:$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$;
$(5)Co\left(OH\right)_{2}$加入盐酸酸溶,发生酸碱中和反应生成盐和水,则“酸溶”中发生反应的离子方程式为$Co\left(OH\right)_{2}+2H^{+}=Co^{2+}+2H_{2}O$,
故答案为:$Co\left(OH\right)_{2}+2H^{+}=Co^{2+}+2H_{2}O$;
$(6)$“电解”$CoCl_{2}$溶液得到$Co$,则阴极上得到$Co$,阴极电极反应式为$Co^{2+}+2e^{-}=Co$,阴极室中的$Cl^{-}$通过阴离子交换膜加入$a$时,阳极上$OH^{-}$放电生成氧气,阳极室中的$H^{+}$通过阳离子交换膜进入$a$时,则电解后$a$室中$HCl$浓度增大,则$a$室中的电解质溶液盐酸可以返回酸溶工序循环使用,
故答案为:$Co^{2+}+2e^{-}=Co$;酸溶。
故答案为:$AlO_{2}^{-}$、$OH^{-}$;
$(2)$通过以上分析知,“酸浸”中$LiCoO_{2}$和稀硫酸、双氧水发生反应生成硫酸锂、硫酸钴、氧气和水,该反应中双氧水作还原剂、$LiCoO_{2}$作氧化剂,该反应的化学方程式为$2LiCoO_{2}+3H_{2}SO_{4}+H_{2}O_{2}=Li_{2}SO_{4}+2CoSO_{4}+O_{2}\uparrow +4H_{2}O$,双氧水不稳定,受热易分解,所以“酸浸”时需要控制温度在$80\sim 85^{\circ}\mathrm{C}$,温度不宜过高,
故答案为:$2LiCoO_{2}+3H_{2}SO_{4}+H_{2}O_{2}=Li_{2}SO_{4}+2CoSO_{4}+O_{2}\uparrow +4H_{2}O$;双氧水受热易分解;
$(3)$如果“酸浸”后的溶液中$Co^{2+}$浓度为$1.0mol\cdot L^{-1}$,“调$pH_{1}$”使$Fe^{3+}$完全转化为沉淀但不$Co^{2+}$不转化为沉淀,$Co^{2+}$生成沉淀时$c(OH^{-})=\sqrt{\frac{(\frac{1{0}^{-14}}{1{0}^{-7.8}})^{2}×0.01}{1.0}}mol/L=10^{-7.2}mol/L$,溶液中$c(H^{+})=\frac{1{0}^{-14}}{1{0}^{-7.2}}mol/L=10^{-6.8}mol/L$,溶液的$pH=6.8$,$Fe^{3+}$完全转化为沉淀时溶液的$pH=3.2$,根据表中数据知,应控制的$pH$范围是$3.2 \lt pH \lt 6.8$,
故答案为:$3.2\sim 6.8$;
$(4)$通过以上分析知,“滤液$2$”含有$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$,则“滤液$2$”中可回收利用的物质主要是$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$,
故答案为:$Li_{2}SO_{4}$、$(NH_{4})_{2}SO_{4}$;
$(5)Co\left(OH\right)_{2}$加入盐酸酸溶,发生酸碱中和反应生成盐和水,则“酸溶”中发生反应的离子方程式为$Co\left(OH\right)_{2}+2H^{+}=Co^{2+}+2H_{2}O$,
故答案为:$Co\left(OH\right)_{2}+2H^{+}=Co^{2+}+2H_{2}O$;
$(6)$“电解”$CoCl_{2}$溶液得到$Co$,则阴极上得到$Co$,阴极电极反应式为$Co^{2+}+2e^{-}=Co$,阴极室中的$Cl^{-}$通过阴离子交换膜加入$a$时,阳极上$OH^{-}$放电生成氧气,阳极室中的$H^{+}$通过阳离子交换膜进入$a$时,则电解后$a$室中$HCl$浓度增大,则$a$室中的电解质溶液盐酸可以返回酸溶工序循环使用,
故答案为:$Co^{2+}+2e^{-}=Co$;酸溶。