题目
5.(1)NaCN属于剧毒物质,有多种无害化处理方法。-|||-①H2O2处理法: +(H)_(2)(O)_(2)arrow (N)_(2)uparrow +X+(H)_(2)O-|||-推测X的化学式为 __ o-|||-②NaClO处理法: (CN)^-+b(ClO)^-+2c(OH)^-=!=!= d(CNO)^-+e(N)_(2)uparrow -|||-+(f{C)_(1)(O)_(3)}^2-+b(Cl)^-+c({H)_(2)}^--|||-方程式中e:f的值为 __ (填选项标号)。-|||-A.1 B. dfrac (1)(2)-|||-C.2 D.不能确定-|||-(2)以TiO2为催化剂用NaClO将 ^- 氧化成 ^- ^- 在酸-|||-性条件下继续与NaClO反应生成N2、CO2、Cl2等。写出-|||-^- 在酸性条件下被NaClO氧化的离子方程式: __-|||-__ o

题目解答
答案
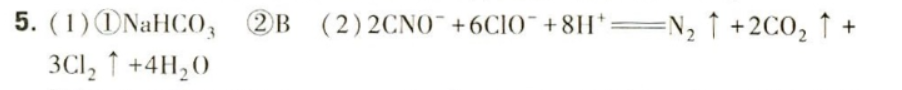
解析
步骤 1:确定反应物和生成物
反应物为NaCN和H2O2,生成物为N2、X和H2O。
步骤 2:根据质量守恒定律,确定X的化学式
反应物NaCN中,N的化合价为-3,C的化合价为+2,H2O2中H的化合价为+1,O的化合价为-1。生成物N2中N的化合价为0,H2O中H的化合价为+1,O的化合价为-2。根据质量守恒定律,反应前后元素的种类和数量不变,因此X中应含有C和O元素,且C的化合价为+4,O的化合价为-2,因此X的化学式为NaHCO3。
【答案】
NaHCO3
②NaClO处理法: $aCN+b{ClO}^{-}+2c{OH}^{-}=\!=\!= dc{NO}^{-}+{e}_{2}\uparrow $ $+{f{C}_{1}{O}_{3}}^{2-}+b{Cl}^{-}+c{{H}_{2}O}^{-}$ 方程式中e:f的值为 __ (填选项标号)。 A.1 B. $\dfrac {1}{2}$ C.2 D.不能确定
【解析】
步骤 1:确定反应物和生成物
反应物为CN、ClO-和OH-,生成物为NO-、N2、ClO3-、Cl-和H2O。
步骤 2:根据氧化还原反应原理,确定e:f的值
反应中CN被氧化为NO-和N2,ClO-被还原为Cl-和ClO3-。根据氧化还原反应原理,氧化剂和还原剂的物质的量之比等于它们得失电子的物质的量之比。因此,e:f的值为1:2。
【答案】
B
(2)以TiO2为催化剂用NaClO将 ${CN}^{-}$ 氧化成 ${CNO}^{-}$ ,${CNO}^{-}$ 在酸 性条件下继续与NaClO反应生成N2、CO2、Cl 2等。写出 ${CNO}^{-}$ 在酸性条件下被NaClO氧化的离子方程式: __
【解析】
步骤 1:确定反应物和生成物
反应物为CNO-和NaClO,生成物为N2、CO2、Cl2和H2O。
步骤 2:根据氧化还原反应原理,写出离子方程式
反应中CNO-被氧化为N2和CO2,NaClO被还原为Cl2。根据氧化还原反应原理,氧化剂和还原剂的物质的量之比等于它们得失电子的物质的量之比。因此,离子方程式为:$2{CNO}^{-}+6{ClO}^{-}+8{H}^{+}=\!=\!= {N}_{2}\uparrow +2C{O}_{2}\uparrow +3{Cl}_{2}\uparrow +4{H}_{2}O$
反应物为NaCN和H2O2,生成物为N2、X和H2O。
步骤 2:根据质量守恒定律,确定X的化学式
反应物NaCN中,N的化合价为-3,C的化合价为+2,H2O2中H的化合价为+1,O的化合价为-1。生成物N2中N的化合价为0,H2O中H的化合价为+1,O的化合价为-2。根据质量守恒定律,反应前后元素的种类和数量不变,因此X中应含有C和O元素,且C的化合价为+4,O的化合价为-2,因此X的化学式为NaHCO3。
【答案】
NaHCO3
②NaClO处理法: $aCN+b{ClO}^{-}+2c{OH}^{-}=\!=\!= dc{NO}^{-}+{e}_{2}\uparrow $ $+{f{C}_{1}{O}_{3}}^{2-}+b{Cl}^{-}+c{{H}_{2}O}^{-}$ 方程式中e:f的值为 __ (填选项标号)。 A.1 B. $\dfrac {1}{2}$ C.2 D.不能确定
【解析】
步骤 1:确定反应物和生成物
反应物为CN、ClO-和OH-,生成物为NO-、N2、ClO3-、Cl-和H2O。
步骤 2:根据氧化还原反应原理,确定e:f的值
反应中CN被氧化为NO-和N2,ClO-被还原为Cl-和ClO3-。根据氧化还原反应原理,氧化剂和还原剂的物质的量之比等于它们得失电子的物质的量之比。因此,e:f的值为1:2。
【答案】
B
(2)以TiO2为催化剂用NaClO将 ${CN}^{-}$ 氧化成 ${CNO}^{-}$ ,${CNO}^{-}$ 在酸 性条件下继续与NaClO反应生成N2、CO2、Cl 2等。写出 ${CNO}^{-}$ 在酸性条件下被NaClO氧化的离子方程式: __
【解析】
步骤 1:确定反应物和生成物
反应物为CNO-和NaClO,生成物为N2、CO2、Cl2和H2O。
步骤 2:根据氧化还原反应原理,写出离子方程式
反应中CNO-被氧化为N2和CO2,NaClO被还原为Cl2。根据氧化还原反应原理,氧化剂和还原剂的物质的量之比等于它们得失电子的物质的量之比。因此,离子方程式为:$2{CNO}^{-}+6{ClO}^{-}+8{H}^{+}=\!=\!= {N}_{2}\uparrow +2C{O}_{2}\uparrow +3{Cl}_{2}\uparrow +4{H}_{2}O$