题目
"习题22 某含有不挥发性溶质的理想水溶液,其凝固点为 -(1.5)^circ C, 试求算该溶液的-|||-(1)正常沸点;(2)25℃时的蒸气压(该温度时纯水的蒸气压为 .17times (10)^3Pa; (3)25、℃时-|||-的渗透压。(已知冰的熔化热为 .03kJcdot mol. 水的气化热为 .7kJcdot mol, 设二者均-|||-不随温度而变化。)-|||-[答案:100.42℃; .12times (10)^3Pa; .00times (10)^6(P)_(a) ]

题目解答
答案
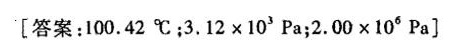
解析
步骤 1:计算溶液的凝固点降低常数
根据凝固点降低公式 $\Delta T_f = K_f \cdot m$,其中 $\Delta T_f$ 是凝固点降低值,$K_f$ 是溶剂的凝固点降低常数,$m$ 是溶质的摩尔浓度。已知 $\Delta T_f = 1.5^{\circ}C$,$K_f$ 对于水是 $1.86^{\circ}C\cdot kg\cdot mol^{-1}$,可以计算出摩尔浓度 $m$。
步骤 2:计算溶液的沸点升高
根据沸点升高公式 $\Delta T_b = K_b \cdot m$,其中 $\Delta T_b$ 是沸点升高值,$K_b$ 是溶剂的沸点升高常数,$m$ 是溶质的摩尔浓度。已知 $K_b$ 对于水是 $0.512^{\circ}C\cdot kg\cdot mol^{-1}$,可以计算出沸点升高值 $\Delta T_b$。
步骤 3:计算溶液在25℃时的蒸气压
根据拉乌尔定律,溶液的蒸气压 $P$ 与纯溶剂的蒸气压 $P^{\circ}$ 之间的关系为 $P = P^{\circ} \cdot X$,其中 $X$ 是溶剂的摩尔分数。已知纯水在25℃时的蒸气压为 $3.17\times 10^3 Pa$,可以计算出溶液的蒸气压。
步骤 4:计算溶液在25℃时的渗透压
根据渗透压公式 $\Pi = i \cdot c \cdot R \cdot T$,其中 $\Pi$ 是渗透压,$i$ 是溶质的解离系数,$c$ 是溶质的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。已知 $i = 1$,$c = m$,$R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$,$T = 298 K$,可以计算出渗透压。
根据凝固点降低公式 $\Delta T_f = K_f \cdot m$,其中 $\Delta T_f$ 是凝固点降低值,$K_f$ 是溶剂的凝固点降低常数,$m$ 是溶质的摩尔浓度。已知 $\Delta T_f = 1.5^{\circ}C$,$K_f$ 对于水是 $1.86^{\circ}C\cdot kg\cdot mol^{-1}$,可以计算出摩尔浓度 $m$。
步骤 2:计算溶液的沸点升高
根据沸点升高公式 $\Delta T_b = K_b \cdot m$,其中 $\Delta T_b$ 是沸点升高值,$K_b$ 是溶剂的沸点升高常数,$m$ 是溶质的摩尔浓度。已知 $K_b$ 对于水是 $0.512^{\circ}C\cdot kg\cdot mol^{-1}$,可以计算出沸点升高值 $\Delta T_b$。
步骤 3:计算溶液在25℃时的蒸气压
根据拉乌尔定律,溶液的蒸气压 $P$ 与纯溶剂的蒸气压 $P^{\circ}$ 之间的关系为 $P = P^{\circ} \cdot X$,其中 $X$ 是溶剂的摩尔分数。已知纯水在25℃时的蒸气压为 $3.17\times 10^3 Pa$,可以计算出溶液的蒸气压。
步骤 4:计算溶液在25℃时的渗透压
根据渗透压公式 $\Pi = i \cdot c \cdot R \cdot T$,其中 $\Pi$ 是渗透压,$i$ 是溶质的解离系数,$c$ 是溶质的摩尔浓度,$R$ 是理想气体常数,$T$ 是绝对温度。已知 $i = 1$,$c = m$,$R = 8.314 J\cdot mol^{-1}\cdot K^{-1}$,$T = 298 K$,可以计算出渗透压。