题目
原电池 (s)|AgCl(s)|HCl(a)|(Cl)_(2)(g,P)| Pt的电池反应可写成以下-|||-两种方式:-|||-(s)+dfrac (1)(2)(Cl)_(2)(g)=!=!= AgCl(s) (1) △,ca(1),E(1)-|||-(s)+(Cl)_(2)(g)=!=!= 2AgCl(s) (2) △,Gm(2),E(2)-|||-则 (Delta )_(r)(G)_(m)(1) ()Delta ,(G)_(m)(2), E(1) () E(2)。
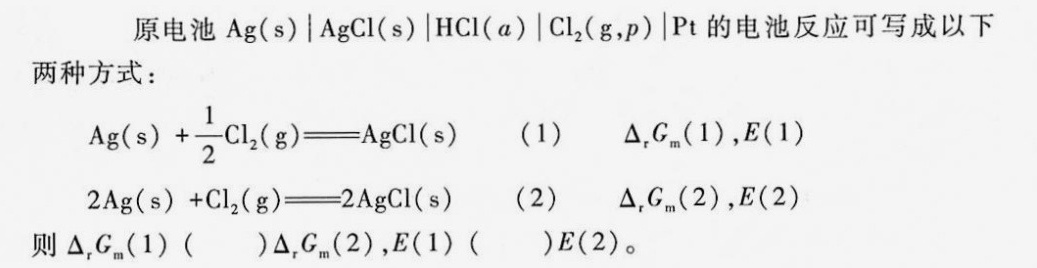
题目解答
答案

解析
本题考查原电池中电池反应的吉布斯自由能变($\Delta_{r}G_{m}$)和电动势($E$)与电池反应计量系数的关系。解题思路如下:
- 分析电动势与电池反应的关系:
- 原电池的电动势是电池本身的性质,只取决于电池的组成和温度等条件,与电池反应的书写方式无关。
- 对于给定的原电池 $Ag(s)|AgCl(s)|HCl(a)|{Cl}_{2}(g,p)||$ Pt,无论电池反应写成 $Ag(s)+\dfrac {1}{2}{Cl}_{2}(g)=\!=\!= AgCl(s)$ 还是 $2Ag(s)+{Cl}_{2}(g)\rightleftharpoons 2AgCl(s)$,它始终是同一个电池,所以电动势的值是相同的,即 $E(1)=E(2)$。
- 分析吉布斯自由能变与电池反应的关系:
- 吉布斯自由能变与电池电动势之间的关系可以用公式 $\Delta_{r}G_{m}=-zFE$ 表示,其中 $z$ 是电池反应中转移的电子数,$F$ 是法拉第常数($F = 96485\ C/mol$),$E$ 是电池电动势。
- 对于反应(1)$Ag(s)+\dfrac {1}{2}{Cl}_{2}(g)=\!=\!= AgCl(s)$,当反应进度 $\xi = 1mol$ 时,$Ag$ 失去 $1$ 个电子变成 $Ag^+$,然后与 $Cl^-$ 结合生成 $AgCl$,所以转移的电子数 $z_1 = 1$。根据公式可得 $\Delta_{r}G_{m}(1)=-z_1FE(1)=-1\times F\times E(1)$。
- 对于反应(2)$2Ag(s)+{Cl}_{2}(g)\rightleftharpoons 2AgCl(s)$,当反应进度 $\xi = 1mol$ 时,$2$ 个 $Ag$ 原子失去 $2$ 个电子变成 $2$ 个 $Ag^+$,然后与 $2$ 个 $Cl^-$ 结合生成 $2$ 个 $AgCl$,所以转移的电子数 $z_2 = 2$。根据公式可得 $\Delta_{r}G_{m}(2)=-z_2FE(2)=-2\times F\times E(2)$。
- 因为 $E(1)=E(2)$,所以 $\Delta_{r}G_{m}(2)=2\Delta_{r}G_{m}(1)$。