题目
某一化学反应,在298K和一定的压力下进行,当反应进度为1mol时,放热40.0kJ。若使反应通过可逆电池来完成,反应程度相同,则吸热4.0kJ。(1)计算反应进度为1mol时的熵变⊿rSm;(2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题;(3)计算系统可能做的最大功的值。
某一化学反应,在298K和一定的压力下进行,当反应进度为1mol时,放热40.0kJ。若使反应通过可逆电池来完成,反应程度相同,则吸热4.0kJ。
(1)计算反应进度为1mol时的熵变⊿rSm;
(2)当反应不通过可逆电池完成时,求环境的熵变和隔离系统的总熵变,从隔离系统的总熵变值说明了什么问题;
(3)计算系统可能做的最大功的值。
题目解答
答案
解:(1)反应通过可逆电池来完成,QR=4.0×103J
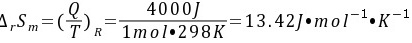
(2) 反应不通过可逆电池来完成,则环境吸热40×103J。
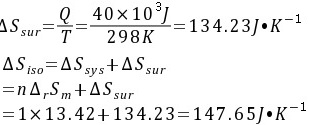
故这一化学反应组成的隔离系统是不可逆的过程。
(3)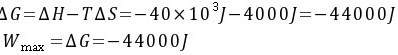
570两种硫化汞晶体转换反应: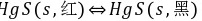 ,转换反应的标准Gibbs自由能的变化值与温度的关系为:
,转换反应的标准Gibbs自由能的变化值与温度的关系为: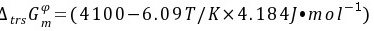 。
。
(1)问在373K时,哪一种硫化汞晶体较为稳定?
(2)求该反应的转换温度。
解:(1)在373K时
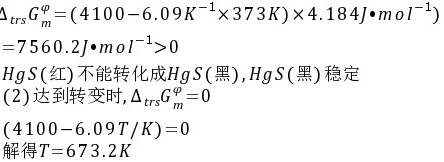
解析
步骤 1:计算反应通过可逆电池完成时的熵变
反应通过可逆电池完成时,吸热4.0kJ,即QR=4.0×10^3J。根据熵变的定义,熵变等于热量除以温度,即:
${\Delta S}_{m} = \frac{Q_R}{T} = \frac{4000J}{298K} = 13.42J\cdot mol^{-1}\cdot K^{-1}$
步骤 2:计算反应不通过可逆电池完成时的环境熵变
反应不通过可逆电池完成时,放热40.0kJ,即Q=-40.0×10^3J。环境吸热,因此环境熵变为:
${\Delta S}_{env} = \frac{Q}{T} = \frac{40000J}{298K} = 134.23J\cdot K^{-1}$
步骤 3:计算隔离系统的总熵变
隔离系统的总熵变等于系统熵变与环境熵变之和,即:
${\Delta S}_{total} = {\Delta S}_{sys} + {\Delta S}_{env} = 13.42J\cdot mol^{-1}\cdot K^{-1} + 134.23J\cdot K^{-1} = 147.65J\cdot K^{-1}$
隔离系统的总熵变大于零,说明该过程是不可逆的。
步骤 4:计算系统可能做的最大功
系统可能做的最大功等于反应的Gibbs自由能变化,即:
${\Delta G} = {\Delta H} - T{\Delta S} = -40000J - 298K \times 13.42J\cdot mol^{-1}\cdot K^{-1} = -44000J$
反应通过可逆电池完成时,吸热4.0kJ,即QR=4.0×10^3J。根据熵变的定义,熵变等于热量除以温度,即:
${\Delta S}_{m} = \frac{Q_R}{T} = \frac{4000J}{298K} = 13.42J\cdot mol^{-1}\cdot K^{-1}$
步骤 2:计算反应不通过可逆电池完成时的环境熵变
反应不通过可逆电池完成时,放热40.0kJ,即Q=-40.0×10^3J。环境吸热,因此环境熵变为:
${\Delta S}_{env} = \frac{Q}{T} = \frac{40000J}{298K} = 134.23J\cdot K^{-1}$
步骤 3:计算隔离系统的总熵变
隔离系统的总熵变等于系统熵变与环境熵变之和,即:
${\Delta S}_{total} = {\Delta S}_{sys} + {\Delta S}_{env} = 13.42J\cdot mol^{-1}\cdot K^{-1} + 134.23J\cdot K^{-1} = 147.65J\cdot K^{-1}$
隔离系统的总熵变大于零,说明该过程是不可逆的。
步骤 4:计算系统可能做的最大功
系统可能做的最大功等于反应的Gibbs自由能变化,即:
${\Delta G} = {\Delta H} - T{\Delta S} = -40000J - 298K \times 13.42J\cdot mol^{-1}\cdot K^{-1} = -44000J$