当今化学界关注的热点之一的C60,它可以看成是金刚石的( ) A.同素异形体 B.同分异构体 C.同位素 D.同系物 4、下列化学反应需要加快化学反应速率的是( ) A.钢铁的腐蚀 B.食物腐烂 C.工业炼钢 D.塑料老化 5、下列物质的电子式书写正确的是( ) 6、已知反应A+3B====2C+D在某段时间以A的浓度变化表示的化学反应速率为1 mol•L-1•min-1,则此段时间内以C的浓度变化表示的化学反应速率为( ) A.0.5 mol•L-1•min-1 B.1 mol•L-1•min-1 C.2 mol•L-1•min-1 D.3 mol•L-1•min-1 7、在元素周期表中金属元素与非金属元素分界线附近,能找到( ) A.耐高温的合金材料 B. 制农药的元素 C. 做催化剂的元素 D. 作半导体材料的元素 8、下列各组中化合物的性质比较,不正确的是 A、酸性:HClO4>H2SO4>H3PO4 B、碱性:NaOH>Mg(OH)2>Al(OH)3 C、稳定性:PH3>H2S> HCl D、非金属性:F>O>S 9、下列四种硫酸溶液,向其中加入铁粉,其中反应最快的是 ( ) A.10℃ 20mL 3mol/L的硫酸溶液 B.20℃ 30mL 18.4mol/L的硫酸溶液 C.20℃ 10mL 4mol/L的硫酸溶液 D.10℃ 10mL 2mol/L的硫酸溶液 10、根据原子序数,下列各组原子能以离子键相结合的是( ) A.2与8 B.6与16 C.8与14 D.9与11 11、某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( ) A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4 12、Na和Na+两种粒子中,不相同的是 ①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数( ) A.① ② B.② ③ C.③ ④ D.② ③ ④ X Y Z 13、短周期元素X,Y,Z在周期表中的位置如右图所示,则下列说法中错误的是( ) A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY C.X能生成HXO D.能发生Cl2+H2Z = Z+2HCl的反应 14、 已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+ 和 Yn-核外电子排布相同,则下列关系式中正确的是( ) A.a =b+m+n B.a=b-m+n C. a=b+m-n D.a=b-m-n 15、下列化合物中,只含有共价键的是( ) A. NH4Cl B. NaCl C. C2H5OH D.K2CO3 16、R元素的原子核外有三个电子层,M层电子数是K层的3倍。下列判断错误的是( ) A.R元素处于第三周期 族 B.R元素的最低化合价为-2价 C.R原子的核外共有14个电子 D.R元素为非金属元素 17、在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g) R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( ) A.P、Q、R、S的浓度相等 B. P、Q、R、S在容器中共存 C.P、Q、R、S的浓度不再变化 D. P、Q的反应速率相等 18、原子电子层数相同的三种短周期元素X、Y、Z,已知最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断中正确的是( ) A.含氧酸的酸性:H3ZO4>H2YO4>HXO4 B.非金属性:Z>Y>X C.气态氢化物的稳定性按X、Y、Z顺序由弱到强 D.元素的负化合价的绝对值按X、Y、Z顺序由小到大 19、硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3的说法不正确的是( ) A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 20、下列物质属于分子晶体且是化合物的是( ) A.石英 B.食盐 C.干冰 D.碘 21、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( ) A.、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E 22、下列叙述中,能肯定A金属比B金属活泼性强的是( ) A.原子的最外层电子数比B原子的最外层电子数少 B.A原子的电子层数比B原子的电子层数多 C.1molA从酸中置换生成的H2比1molB从酸中置换生成的H2多 D.常温下,A能从水中置换出氢,而B不能 23、硒是人体中14种必需的营养元素之一,被誉为“生命的奇效元素”。已知硒元素与硫元素同主族,在硫元素的下一周期,则下列关于硒的叙述中错误的是( ) A、硒的原子半径比氧原子大 B、硒的最高价氧化物对应水化物的化学式为H2SeO3 C、硒的非金属性比氧元素弱 D、硒的气态氢化物H2Se不如硫化氢稳定 24、X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( ) X Y Z W X Y Z W A、原子半径:W>Z>Y>X B、最高价氧化物对应水化物的酸性:Z>W>X C、四种元素的单质中,Z单质氧化性最强 D、W的单质能与水反应,生成一种具有漂白性的物质 X Y Z W X Y Z W 25、两种短周期元素X和Y可组成化合物 ,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是( ) A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤ 二、填空题 26、(10分) (1)写出下列物质的电子式:NH4+ ;H3O+ ; NH3 ;N2 ;MgCl2 。(2)写出下列物质的结构式:CH4_____________; H2O______; CO2 (3)画出下列各微粒的结构示意图: ①与Ne原子电子层结构相同的-2价阴离子的离子结构示意图 ; ②质量数为23,中子数为12的原子的原子结构示意图 。 27、(8分)下列物质中:(1)互为同分异构体的有 (2)互为同素异形体的有 (3)属于同位素的有 (4)属于同一种物质的有 。(填序号)①液氯 ② ③白磷 ④氯气 ⑤ ⑥ Cl ⑦ Cl ⑧红磷 ⑨H2O ⑩D2O 28、(7分)A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: ,B、C可形成离子化合物B3C2,据此填空:(1)A的元素符号为 ,其气态氢化物的化学式为 。 (2)A、B、C、D四种元素的原子,半径由小到大的顺序为 (用元素符号表示)。 (3)B和C最高价氧化物的水化物化学式分别为 和 。 29、(12分)下表是元素周期表的一部分,根据表中10种元素用元素符号或化学式填空。 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ 4 ⑨ ⑧ ⑩ ⑴ 写出①、②两种元素的名称:___________、_____________。 ⑵ 写出⑤、⑧两种元素的符号:___________、_____________。 (3)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。 (4)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ; (5)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ; (6)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 ; 三、计算题(共13分)(可能用到的式量H 1、N 14 、O 16 、Cl 35.5 、Ag 108) 30、(7分)某元素的同位素 ,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求: (1)Z值和A值;(2)X元素在周期表中的位置; (3)写出X与水反应的化学方程式。 31、(6分) 在2L的容器内,反应 刚开始时, 的物质的量为1.5mol 的物质的量2.5 mol, 后测得 浓度为 ,则此时间内,用氮气表示的平均化学反应速率是多少? 时氢气的物质的量浓度是多少? 文成中学2010学年第二学期高一第一次月考 化 学 试 卷 答 案 一、选择题(本题共有25小题,每小题2分,共50分) 27、(共8分,每空2分)②⑤/③⑧/⑥⑦/①④ 28、(共7分) Si SiH4 N < P < Si < Mg (2分) Mg(OH)2 HNO3(2分) 29(共12分,第6小题2分,其余没每空1分)(1)碳 氧 (2) S Ca (3)K Ar (4) Al Al(OH)3+OH-==AlO2-+2H2O (5)HClO4 KOH (6) Ca2+< K+< Cl-<S2- ( 三、计算题 30、(7分)(1)Z=20 A=40 (2)X是钙元素,第四周期、第ⅡA族 (3)Ca + 2H2O === Ca(OH)2 + H2 ↑ 31、(6分) v (氢气)=0.3 mol•L-1•min-1 C (氨气)=0.35 mol•L-1 诸暨市草塔中学2010学年第二学期高一化学期中考试题 高一实验班 化学 试题卷 一.选择题(每题只有一个正确答案) 1.《读卖新闻》3月25日:日本东京电力公司24日宣布,在对福岛第一核电站排水口的海水进行取样化验后,检测出含有微量的放射性物质 。专家表示,这些放射物质来自于核燃料棒。锆被发现了,说明堆心已经彻底熔毁;这不是几年就能解决的问题,最坏的情况发生了。日本前景堪忧!下列关于 的说法正确的是 ( ) A. 属于非金属元素 B. 的中子数和电子数之差为55 C. 和 是同种核素 D. 和 两原子的核外电子总数相等 2.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( ) A.SO2和SiO2 B.CO2和H2 C.NaCl和HCl D.CCl4和KCl 3. 3月29日,环境保护部(国家核安全局)有关负责人就环境辐射监测情况回答了记者关心的问题。这位负责人介绍说,在安徽省、广东省、广西壮族自治区和宁夏回族自治区的监测点气溶胶取样中除检测到了极微量的人工放射性核素碘-131外,还检测到了极微量的人工放射性核素铯-137和铯-134。已知铯是钠的同族元素,关于铯的下列判断中错误的是 ( ) A.它的金属性比钠强 B.它的最外层电子数为1 C.它有7个电子层 D.单质铯的还原性比单质钠强. 4.与Ne的核外电子排布相同的阴离子跟与Ar的核外电子排布相同的阳离子所形成的化合物是( ) A.MgBr2 B.Na2S C.aF2 D.KCl 5.A和B均为短周期元素,它们的离子A- 和B2+具有相同的核外电子层结构。下面说法正确的是( ) A.原子序数为A > B B.核外电子数为A > B C. 原子半径A > B D.离子半径 A- > B2+ 6. 下列有关化学用语的说法中不正确的是( ) A.-OH与 都表示羟基 B.次氯酸的结构式为:H—Cl—O其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2。m(CO2中学学科网(ZX UNDK.COM))=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=7.2 g,所以该有机物的最简式为C∶H=0.5∶(0.6×2)=5∶12,即C5H12,因最简式中氢原子数中学学科网(ZX UNDK.COM)已达饱和,故C5H12就是其分子式,若其一氯代物只有一种,则其结构简式为中学学科网(ZX UNDK.COM)。
当今化学界关注的热点之一的C60,它可以看成是金刚石的( ) A.同素异形体 B.同分异构体 C.同位素 D.同系物 4、下列化学反应需要加快化学反应速率的是( ) A.钢铁的腐蚀 B.食物腐烂 C.工业炼钢 D.塑料老化 5、下列物质的电子式书写正确的是( ) 6、已知反应A+3B====2C+D在某段时间以A的浓度变化表示的化学反应速率为1 mol•L-1•min-1,则此段时间内以C的浓度变化表示的化学反应速率为( ) A.0.5 mol•L-1•min-1 B.1 mol•L-1•min-1 C.2 mol•L-1•min-1 D.3 mol•L-1•min-1 7、在元素周期表中金属元素与非金属元素分界线附近,能找到( ) A.耐高温的合金材料 B. 制农药的元素 C. 做催化剂的元素 D. 作半导体材料的元素 8、下列各组中化合物的性质比较,不正确的是 A、酸性:HClO4>H2SO4>H3PO4 B、碱性:NaOH>Mg(OH)2>Al(OH)3 C、稳定性:PH3>H2S> HCl D、非金属性:F>O>S 9、下列四种硫酸溶液,向其中加入铁粉,其中反应最快的是 ( ) A.10℃ 20mL 3mol/L的硫酸溶液 B.20℃ 30mL 18.4mol/L的硫酸溶液 C.20℃ 10mL 4mol/L的硫酸溶液 D.10℃ 10mL 2mol/L的硫酸溶液 10、根据原子序数,下列各组原子能以离子键相结合的是( ) A.2与8 B.6与16 C.8与14 D.9与11 11、某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为( ) A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4 12、Na和Na+两种粒子中,不相同的是 ①核内质子数 ②核外电子数 ③最外层电子数 ④核外电子层数( ) A.① ② B.② ③ C.③ ④ D.② ③ ④ X Y Z 13、短周期元素X,Y,Z在周期表中的位置如右图所示,则下列说法中错误的是( ) A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY C.X能生成HXO D.能发生Cl2+H2Z = Z+2HCl的反应 14、 已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+ 和 Yn-核外电子排布相同,则下列关系式中正确的是( ) A.a =b+m+n B.a=b-m+n C. a=b+m-n D.a=b-m-n 15、下列化合物中,只含有共价键的是( ) A. NH4Cl B. NaCl C. C2H5OH D.K2CO3 16、R元素的原子核外有三个电子层,M层电子数是K层的3倍。下列判断错误的是( ) A.R元素处于第三周期 族 B.R元素的最低化合价为-2价 C.R原子的核外共有14个电子 D.R元素为非金属元素 17、在一定条件下,对于在密闭容器中进行的反应P(g)+Q(g) R(g)+S(g),下列说法中可以充分说明这一反应已经达到平衡状态的是( ) A.P、Q、R、S的浓度相等 B. P、Q、R、S在容器中共存 C.P、Q、R、S的浓度不再变化 D. P、Q的反应速率相等 18、原子电子层数相同的三种短周期元素X、Y、Z,已知最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断中正确的是( ) A.含氧酸的酸性:H3ZO4>H2YO4>HXO4 B.非金属性:Z>Y>X C.气态氢化物的稳定性按X、Y、Z顺序由弱到强 D.元素的负化合价的绝对值按X、Y、Z顺序由小到大 19、硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2 2SO3的说法不正确的是( ) A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 20、下列物质属于分子晶体且是化合物的是( ) A.石英 B.食盐 C.干冰 D.碘 21、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( ) A.、B、C、D、E B.E、C、D、B、A C.B、A、D、C、E D.C、D、A、B、E 22、下列叙述中,能肯定A金属比B金属活泼性强的是( ) A.原子的最外层电子数比B原子的最外层电子数少 B.A原子的电子层数比B原子的电子层数多 C.1molA从酸中置换生成的H2比1molB从酸中置换生成的H2多 D.常温下,A能从水中置换出氢,而B不能 23、硒是人体中14种必需的营养元素之一,被誉为“生命的奇效元素”。已知硒元素与硫元素同主族,在硫元素的下一周期,则下列关于硒的叙述中错误的是( ) A、硒的原子半径比氧原子大 B、硒的最高价氧化物对应水化物的化学式为H2SeO3 C、硒的非金属性比氧元素弱 D、硒的气态氢化物H2Se不如硫化氢稳定 24、X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( ) X Y Z W X Y Z W A、原子半径:W>Z>Y>X B、最高价氧化物对应水化物的酸性:Z>W>X C、四种元素的单质中,Z单质氧化性最强 D、W的单质能与水反应,生成一种具有漂白性的物质 X Y Z W X Y Z W 25、两种短周期元素X和Y可组成化合物 ,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是( ) A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤ 二、填空题 26、(10分) (1)写出下列物质的电子式:NH4+ ;H3O+ ; NH3 ;N2 ;MgCl2 。(2)写出下列物质的结构式:CH4_____________; H2O______; CO2 (3)画出下列各微粒的结构示意图: ①与Ne原子电子层结构相同的-2价阴离子的离子结构示意图 ; ②质量数为23,中子数为12的原子的原子结构示意图 。 27、(8分)下列物质中:(1)互为同分异构体的有 (2)互为同素异形体的有 (3)属于同位素的有 (4)属于同一种物质的有 。(填序号)
①液氯 ② ③白磷 ④氯气 ⑤ ⑥ Cl ⑦ Cl ⑧红磷 ⑨H2O ⑩D2O 28、(7分)A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为: ,B、C可形成离子化合物B3C2,据此填空:(1)A的元素符号为 ,其气态氢化物的化学式为 。 (2)A、B、C、D四种元素的原子,半径由小到大的顺序为 (用元素符号表示)。 (3)B和C最高价氧化物的水化物化学式分别为 和 。 29、(12分)下表是元素周期表的一部分,根据表中10种元素用元素符号或化学式填空。 主族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0族 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ 4 ⑨ ⑧ ⑩ ⑴ 写出①、②两种元素的名称:___________、_____________。 ⑵ 写出⑤、⑧两种元素的符号:___________、_____________。 (3)①~⑩元素中,金属性最强的是 ;化学性质最不活泼的是 。 (4)①~⑩元素中,最高价氧化物水化物呈两性的是 ,该化合物与NaOH溶液反应的离子方程式为 ; (5)①~⑩元素中,最高价氧化物水化物酸性最强的是 ,碱性最强的是 ; (6)⑤、⑥、⑧、⑨所形成的离子,其半径由小到大的顺序是 ; 三、计算题(共13分)(可能用到的式量H 1、N 14 、O 16 、Cl 35.5 、Ag 108) 30、(7分)某元素的同位素 ,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求: (1)Z值和A值;(2)X元素在周期表中的位置; (3)写出X与水反应的化学方程式。 31、(6分) 在2L的容器内,反应 刚开始时, 的物质的量为1.5mol 的物质的量2.5 mol, 后测得 浓度为 ,则此时间内,用氮气表示的平均化学反应速率是多少? 时氢气的物质的量浓度是多少? 文成中学2010学年第二学期高一第一次月考 化 学 试 卷 答 案 一、选择题(本题共有25小题,每小题2分,共50分) 27、(共8分,每空2分)②⑤/③⑧/⑥⑦/①④ 28、(共7分) Si SiH4 N < P < Si < Mg (2分) Mg(OH)2 HNO3(2分) 29(共12分,第6小题2分,其余没每空1分)(1)碳 氧 (2) S Ca (3)K Ar (4) Al Al(OH)3+OH-==AlO2-+2H2O (5)HClO4 KOH (6) Ca2+< K+< Cl-<S2- ( 三、计算题 30、(7分)(1)Z=20 A=40 (2)X是钙元素,第四周期、第ⅡA族 (3)Ca + 2H2O === Ca(OH)2 + H2 ↑ 31、(6分) v (氢气)=0.3 mol•L-1•min-1 C (氨气)=0.35 mol•L-1
诸暨市草塔中学2010学年第二学期高一化学期中考试题 高一实验班 化学 试题卷 一.选择题(每题只有一个正确答案) 1.《读卖新闻》3月25日:日本东京电力公司24日宣布,在对福岛第一核电站排水口的海水进行取样化验后,检测出含有微量的放射性物质 。专家表示,这些放射物质来自于核燃料棒。锆被发现了,说明堆心已经彻底熔毁;这不是几年就能解决的问题,最坏的情况发生了。日本前景堪忧!下列关于 的说法正确的是 ( ) A. 属于非金属元素 B. 的中子数和电子数之差为55 C. 和 是同种核素 D. 和 两原子的核外电子总数相等 2.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( ) A.SO2和SiO2 B.CO2和H2 C.NaCl和HCl D.CCl4和KCl 3. 3月29日,环境保护部(国家核安全局)有关负责人就环境辐射监测情况回答了记者关心的问题。这位负责人介绍说,在安徽省、广东省、广西壮族自治区和宁夏回族自治区的监测点气溶胶取样中除检测到了极微量的人工放射性核素碘-131外,还检测到了极微量的人工放射性核素铯-137和铯-134。已知铯是钠的同族元素,关于铯的下列判断中错误的是 ( ) A.它的金属性比钠强 B.它的最外层电子数为1 C.它有7个电子层 D.单质铯的还原性比单质钠强. 4.与Ne的核外电子排布相同的阴离子跟与Ar的核外电子排布相同的阳离子所形成的化合物是( ) A.MgBr2 B.Na2S C.aF2 D.KCl 5.A和B均为短周期元素,它们的离子A- 和B2+具有相同的核外电子层结构。下面说法正确的是( ) A.原子序数为A > B B.核外电子数为A > B C. 原子半径A > B D.离子半径 A- > B2+ 6. 下列有关化学用语的说法中不正确的是( ) A.-OH与 都表示羟基 B.次氯酸的结构式为:H—Cl—O
其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2。
m(CO2 )=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则
)=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则
n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=
7.2 g,所以该有机物的最简式为C∶H=0.5∶(0.6×2)
=5∶12,即C5H12,因最简式中氢原子数 已达饱和,故C5H12就
已达饱和,故C5H12就
是其分子式,若其一氯代物只有一种,则其结构简式为
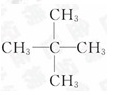 。
。
题目解答
答案
答案:(1)g→f,e→h,i→c,d→a (2)吸收水分,得到干燥纯净的O2 (3)作催化剂,加快产生O2的速率
(4)C5H12 (5)不 