下表是元素周期表的一部分,回答下列有关问题:族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅧA2①②3③④⑤⑥⑦⑧⑨4⑩⑪⑫(1)写出下列元素符号:① N ,⑥ Si ,⑦ S .(2)画出原子的结构示意图:④ +12 2 8 2 ,⑧ +12 2 8 2 .(3)在上述标出元素中,金属性最强的元素是 K ,非金属性最强的元素是_ F ,最不活泼的元素是 Ar .(均填元素符号(4)元素⑦与元素⑧相比,非金属性较强的是 Cl (用元素符号表示),下列表述中能证明这一事实的是 b .(选填序号)a.常温下⑦的单质和⑧的单质状态不同b.⑧的氢化物比⑦的氢化物稳定c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应(5)第三周期中原子半径最大的元素是 Na (填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是 Cl (填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式 OH﹣+H+═H2OC.+12 2 8 2 X+一定具有稀有气体元素原子的核外电子排布D.它们的化学性质几乎完全相同9.下列说法不正确的是( )A.+12 2 8 2 I与+12 2 8 2I互为同位素B.Na+的结构示意图为+12 2 8 2C.高氯酸(HClO4)中氯元素的化合价为+7D.I和Cl是同一主族元素,HI比HCl稳定10.我国西部地区蕴藏着丰富的锂资源,下列关于锂的叙述不正确的是( )A.和锂同一主族的都是金属元素B.LiOH的碱性比NaOH的弱C.锂的化学性质不如钠活泼D.Li在空气中燃烧生成Li2O11.质子数≤18的A和M两种元素,已知A2﹣与M+的电子数之差为8,则下列说法正确的是( )A.和M原子的最外层电子数之差不一定为5B.A和M原子的最外层电子数之和一定为7C.A和M原子的电子数之差一定为11D.A和M的原子序数之差不一定为512.X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )A.X原子的电子层数比Y原子的电子层数多B.X的氢化物的沸点比Y的氢化物沸点低C.X的气态氢化物比Y的气态氢化物稳定D.Y的单质能将X从NaX的溶液中置换出来13.230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )①Th元素的质量数是232 ②Th元素的相对原子质量是231③232Th转换成233U是化学变化 ④230Th和232Th的化学性质相同⑤230Th和232Th具有相同的最外层电子.A.①② B.③④ C.②⑤ D.④⑤14.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )A.标准状况下,1.12L氦气所含原子数为0。1NAB.1.6gNH2﹣离子所含质子数为NAC.22。4 LHCl溶于水,溶液中H+数为NAD.9g D2O所含的中子数为4。5NA15.原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是( )(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式: CO2+NaOH═NaHCO3 ..
下表是元素周期表的一部分,回答下列有关问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅧA
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
⑪
⑫
(1)写出下列元素符号:① N ,⑥ Si ,⑦ S .
(2)画出原子的结构示意图:④  ,⑧
,⑧  .
.
(3)在上述标出元素中,金属性最强的元素是 K ,非金属性最强的元素是_ F ,最不活泼的元素是 Ar .(均填元素符号
(4)元素⑦与元素⑧相比,非金属性较强的是 Cl (用元素符号表示),下列表述中能证明这一事实的是 b .(选填序号)
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素是 Na (填元素符号),跟它同周期原子半径(除稀有气体外)最小的元素是 Cl (填元素符号)它们最高价氧化物对应水化物之间反应的离子方程式 OH﹣+H+═H2O
C.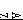 X+一定具有稀有气体元素原子的核外电子排布
X+一定具有稀有气体元素原子的核外电子排布
D.它们的化学性质几乎完全相同
9.下列说法不正确的是( )
A. I与
I与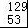 I互为同位素
I互为同位素
B.Na+的结构示意图为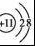
C.高氯酸(HClO4)中氯元素的化合价为+7
D.I和Cl是同一主族元素,HI比HCl稳定
10.我国西部地区蕴藏着丰富的锂资源,下列关于锂的叙述不正确的是( )
A.和锂同一主族的都是金属元素
B.LiOH的碱性比NaOH的弱
C.锂的化学性质不如钠活泼
D.Li在空气中燃烧生成Li2O
11.质子数≤18的A和M两种元素,已知A2﹣与M+的电子数之差为8,则下列说法正确的是( )
A.和M原子的最外层电子数之差不一定为5
B.A和M原子的最外层电子数之和一定为7
C.A和M原子的电子数之差一定为11
D.A和M的原子序数之差不一定为5
12.X、Y是元素周期表中ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
13.230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
①Th元素的质量数是232 ②Th元素的相对原子质量是231
③232Th转换成233U是化学变化 ④230Th和232Th的化学性质相同
⑤230Th和232Th具有相同的最外层电子.
A.①② B.③④ C.②⑤ D.④⑤
14.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.标准状况下,1.12L氦气所含原子数为0。1NA
B.1.6gNH2﹣离子所含质子数为NA
C.22。4 LHCl溶于水,溶液中H+数为NA
D.9g D2O所含的中子数为4。5NA
15.原子序数为Z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是( )
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,足量该元素的常见氧化物通入③的最高价氧化物的水化物的溶液中,写出化学方程式: CO2+NaOH═NaHCO3 .
.题目解答
答案
[解答]解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为S,⑧为Cl,⑨为Ar,⑩为K,⑪为Ca,⑫为Br,
(1)由上述分析可知①为N,⑥为Si,⑦为S,故答案为:N;Si;S;
(2)④Mg的原子结构示意图为 ,⑧的原子结构示意图为
,⑧的原子结构示意图为 ,
,
故答案为: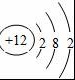 ;
; ;
;
(3)以上元素中金属性最强的是K,非金属性最强的是F,Ar的最外层电子数为8,则Ar最不活泼,故答案为:K;F;Ar;
(4)⑦为S,⑧为Cl,同周期元素从左向右元素的非金属增强,则Cl的非金属性强,可利用气态氢化物的稳定性来验证,二者的状态及与碱的反应不能说明,
故答案为:Cl;b;
(5)第三周期从左向右原子半径在减小,则Na的原子半径最大,原子半径最小的为Cl,它们最高价氧化物对应水化物之间反应的离子方程式为OH﹣+H+═H2O,
故答案为:Na;Cl;OH﹣+H+═H2O;
(6)某元素原子最外层电子数是其次外层电子数的2倍,为C元素,足量该元素的常见氧化物二氧化碳通入③的最高价氧化物的水化物NaOH的溶液中的化学反应方程式为CO2+NaOH═NaHCO3,故答案为:CO2+NaOH═NaHCO3.
.