题目
3.测定1.0239g某样品中的P2O5的含量时,用MgCl,NH4Cl、NH3·H2O使磷沉淀为MgNH4 PO4。过滤、-|||-洗涤后灼烧成Mg2P22O7,称量的质量为0.2836g。计算样品中P 2O5的质量分数。 _({P)_(2)(O)_(5)}=141.95,-|||-(M)_({B)_(2)}(P)_(2)(O)_(7)=222.25)

题目解答
答案
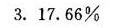
解析
步骤 1:确定化学反应方程式
在该问题中,磷(P)首先沉淀为MgNH4PO4,然后在灼烧过程中转化为Mg2P2O7。因此,我们需要考虑磷在两种化合物中的化学计量关系。
步骤 2:计算Mg2P2O7中磷的质量
根据Mg2P2O7的摩尔质量(222.25 g/mol)和样品中Mg2P2O7的质量(0.2836 g),我们可以计算出Mg2P2O7中磷的质量。
步骤 3:计算样品中P2O5的质量分数
根据Mg2P2O7中磷的质量和P2O5的摩尔质量(141.95 g/mol),我们可以计算出样品中P2O5的质量,然后计算出P2O5的质量分数。
在该问题中,磷(P)首先沉淀为MgNH4PO4,然后在灼烧过程中转化为Mg2P2O7。因此,我们需要考虑磷在两种化合物中的化学计量关系。
步骤 2:计算Mg2P2O7中磷的质量
根据Mg2P2O7的摩尔质量(222.25 g/mol)和样品中Mg2P2O7的质量(0.2836 g),我们可以计算出Mg2P2O7中磷的质量。
步骤 3:计算样品中P2O5的质量分数
根据Mg2P2O7中磷的质量和P2O5的摩尔质量(141.95 g/mol),我们可以计算出样品中P2O5的质量,然后计算出P2O5的质量分数。