题目
某弱酸的 pKa = 9.21,现有其共轭碱 NaA溶液 20.00 mL,浓度为 0.1000 mol·L-1,当用 0.1000 mol·L-1 HCl 溶液滴定时,化学计量点的pH 为多少?化学计量点附近的滴定突跃为多少?应选用何种指示剂?
某弱酸的 pKa = 9.21,现有其共轭碱 NaA溶液 20.00 mL,浓度为 0.1000 mol·L-1,当用 0.1000 mol·L-1 HCl 溶液滴定时,化学计量点的pH 为多少?化学计量点附近的滴定突跃为多少?应选用何种指示剂?
题目解答
答案
解:

化学计量点时,产物为HA,且c(HA)=0.05000 mol·L-1
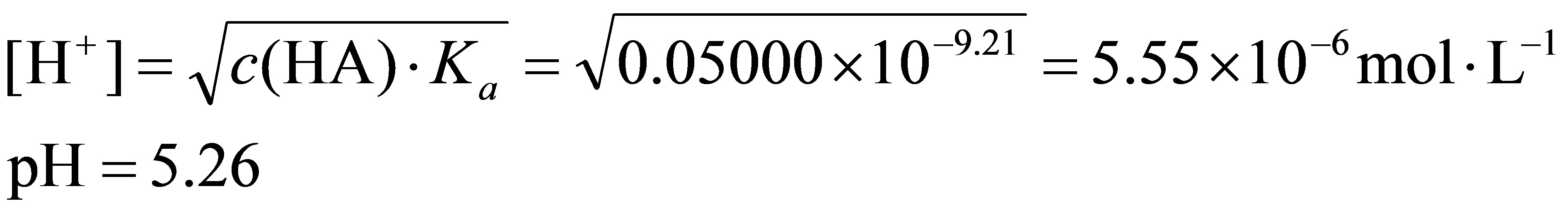
滴定误差为 -0.1%时,溶液组成为HA + A-,且
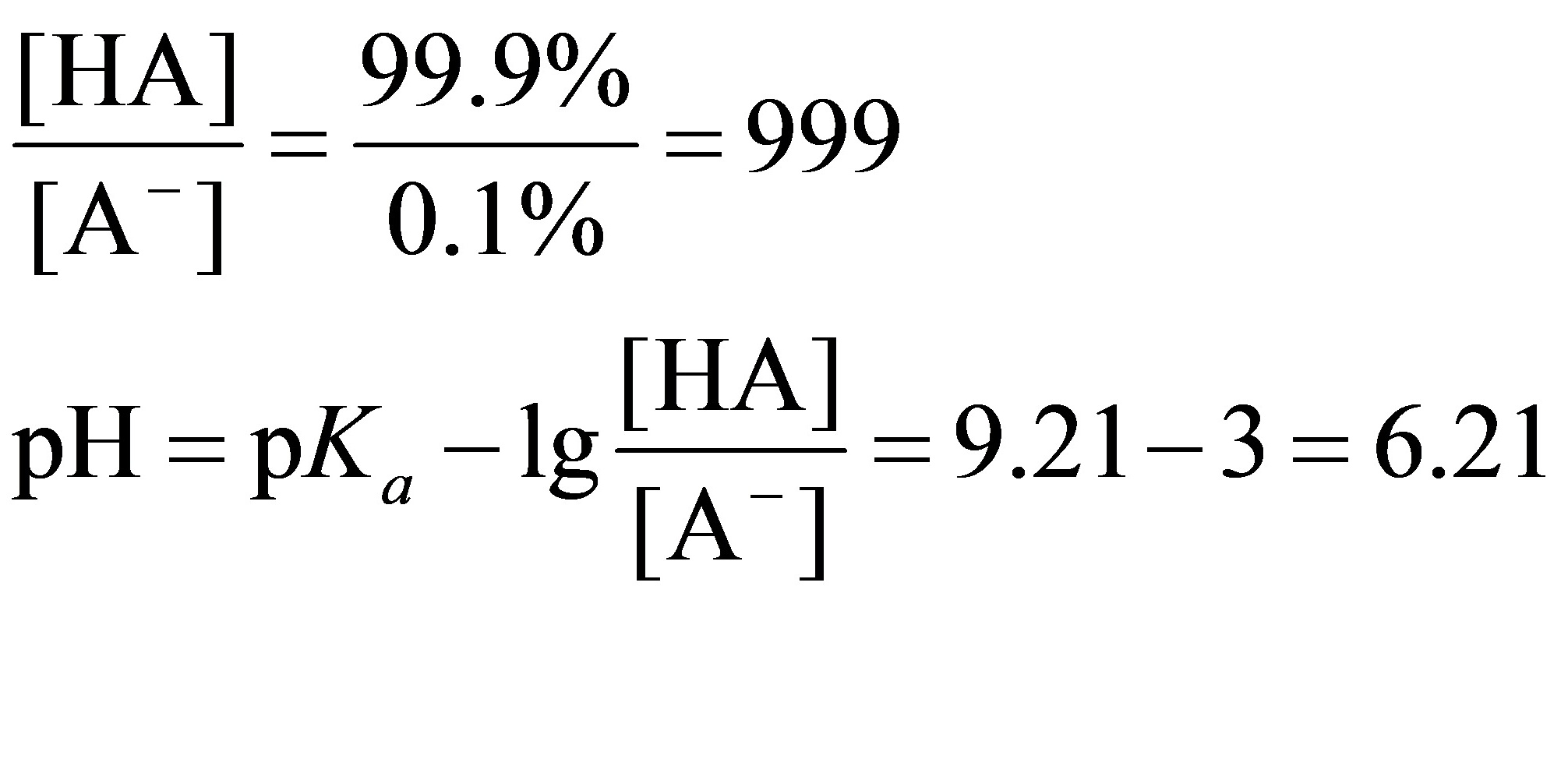
误差为 +0.1%时,溶液组成为HCl + HA,HCl抑制HA解离,
溶液中的氢离子主要来源于HCl的完全解离。

解析
步骤 1:计算共轭碱的碱度常数
弱酸的 pKa = 9.21,因此其共轭碱的碱度常数 ${K}_{b}$ 可以通过 ${K}_{w}$ 计算得到,其中 ${K}_{w} = 10^{-14}$。
步骤 2:确定化学计量点的pH
化学计量点时,共轭碱 NaA 完全被 HCl 中和,生成弱酸 HA。此时,溶液中 HA 的浓度为 0.05000 mol·L-1,pH 可以通过 HA 的 pKa 计算得到。
步骤 3:计算滴定突跃
滴定突跃是指在滴定过程中,pH 值发生显著变化的范围。在化学计量点附近,当滴定误差为 -0.1% 和 +0.1% 时,分别计算溶液的 pH 值,从而确定滴定突跃。
步骤 4:选择指示剂
根据滴定突跃范围,选择合适的指示剂,指示剂的变色范围应与滴定突跃范围相匹配。
弱酸的 pKa = 9.21,因此其共轭碱的碱度常数 ${K}_{b}$ 可以通过 ${K}_{w}$ 计算得到,其中 ${K}_{w} = 10^{-14}$。
步骤 2:确定化学计量点的pH
化学计量点时,共轭碱 NaA 完全被 HCl 中和,生成弱酸 HA。此时,溶液中 HA 的浓度为 0.05000 mol·L-1,pH 可以通过 HA 的 pKa 计算得到。
步骤 3:计算滴定突跃
滴定突跃是指在滴定过程中,pH 值发生显著变化的范围。在化学计量点附近,当滴定误差为 -0.1% 和 +0.1% 时,分别计算溶液的 pH 值,从而确定滴定突跃。
步骤 4:选择指示剂
根据滴定突跃范围,选择合适的指示剂,指示剂的变色范围应与滴定突跃范围相匹配。