题目
【题文】某学生欲用已知物质的量浓度的盐酸来滴定并测定未知物质的量浓度的氢氧化钠溶液,选择甲基橙作指示剂。请填空:(1)用已知物质的量浓度的盐酸滴定时,应将盐酸注入滴定管___________(选填“甲”或“乙”)中。(2)(2)用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液___________,并在半分钟内不变色为止。(3)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是___________。 A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 B.酸式滴定管在滴定前有气泡,滴定后气泡消失 C.读取盐酸体积时,滴定结束时俯视读数 D.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 (4)若滴定开始和结束时,滴定管中的液面如图示,则所用盐酸溶液的体积为___________ mL。(2)(5)某学生根据二次实验分别记录有关数据如下表: 滴定次数 待测氢氧化钠溶液的体积/mL 0.1000 mol∙L−1盐酸的体积/mL 滴定前刻度 滴定后刻度 第一次 25.00 0.00 26.11 第二次 25.00 0.22 26.31 请用上述数据计算该NaOH溶液的物质的量浓度c(NaOH)= ___________ 。
【题文】某学生欲用已知物质的量浓度的盐酸来滴定并测定未知物质的量浓度的氢氧化钠溶液,选择甲基橙作指示剂。请填空:
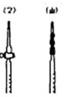
(1)用已知物质的量浓度的盐酸滴定时,应将盐酸注入滴定管___________(选填“甲”或“乙”)中。
(2)用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液___________,并在半分钟内不变色为止。
(3)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是___________。
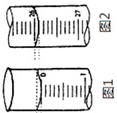
(4)若滴定开始和结束时,滴定管中的液面如图示,则所用盐酸溶液的体积为___________ mL。
(5)某学生根据二次实验分别记录有关数据如下表:
请用上述数据计算该NaOH溶液的物质的量浓度c(NaOH)= ___________ 。
(1)用已知物质的量浓度的盐酸滴定时,应将盐酸注入滴定管___________(选填“甲”或“乙”)中。

(2)用已知物质的量浓度的盐酸滴定未知物质的量浓度的氢氧化钠溶液时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到因加入一滴盐酸后,溶液___________,并在半分钟内不变色为止。
(3)下列操作中,可能使所测氢氧化钠溶液的浓度值偏低的是___________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| C.读取盐酸体积时,滴定结束时俯视读数 |
| D.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |

(5)某学生根据二次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000 mol∙L−1盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 0.22 | 26.31 |
题目解答
答案
【答案】
(1)乙
(2)由黄色变为橙色
(3)C
(4)26.10
(5)0.1044 mol∙L−1
(1)乙
(2)由黄色变为橙色
(3)C
(4)26.10
(5)0.1044 mol∙L−1
解析
(1)酸式滴定管用于盛放酸性溶液,因此应将盐酸注入滴定管乙中。
(2)甲基橙在酸性溶液中显红色,在碱性溶液中显黄色,滴定终点时,溶液由黄色变为橙色。
(3)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,导致盐酸浓度偏低,消耗盐酸体积偏大,所测氢氧化钠溶液的浓度值偏高,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致消耗盐酸体积偏大,所测氢氧化钠溶液的浓度值偏高,故B错误;
C.读取盐酸体积时,滴定结束时俯视读数,导致消耗盐酸体积偏小,所测氢氧化钠溶液的浓度值偏低,故C正确;
D.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,对消耗盐酸体积无影响,所测氢氧化钠溶液的浓度值无影响,故D错误;
(4)滴定管的最小刻度为0.1mL,滴定开始时,滴定管中液面读数为0.00mL,滴定结束时,滴定管中液面读数为26.10mL,所用盐酸溶液的体积为26.10mL。
(5)第一次消耗盐酸体积为26.11mL,第二次消耗盐酸体积为26.09mL,两次消耗盐酸体积平均值为26.10mL,根据c(NaOH)×V(NaOH)=c(HCl)×V(HCl)计算c(NaOH)。
(2)甲基橙在酸性溶液中显红色,在碱性溶液中显黄色,滴定终点时,溶液由黄色变为橙色。
(3)A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,导致盐酸浓度偏低,消耗盐酸体积偏大,所测氢氧化钠溶液的浓度值偏高,故A错误;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致消耗盐酸体积偏大,所测氢氧化钠溶液的浓度值偏高,故B错误;
C.读取盐酸体积时,滴定结束时俯视读数,导致消耗盐酸体积偏小,所测氢氧化钠溶液的浓度值偏低,故C正确;
D.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,对消耗盐酸体积无影响,所测氢氧化钠溶液的浓度值无影响,故D错误;
(4)滴定管的最小刻度为0.1mL,滴定开始时,滴定管中液面读数为0.00mL,滴定结束时,滴定管中液面读数为26.10mL,所用盐酸溶液的体积为26.10mL。
(5)第一次消耗盐酸体积为26.11mL,第二次消耗盐酸体积为26.09mL,两次消耗盐酸体积平均值为26.10mL,根据c(NaOH)×V(NaOH)=c(HCl)×V(HCl)计算c(NaOH)。