题目
4.6 在293 K时,氨的水溶液A中NH3与H 2O的摩尔比为1:8.5,溶液A上方NH3的-|||-分压为10.64 kPa;氨的水溶液B中NH3与H2O的摩尔比为1:21,溶液B上方NH 3的分压为-|||-3.597kPa。在相同温度下,试求:-|||-(1)从大量的溶液A中转移1mol NH3(g)到大量的溶液B中的 Delta G;-|||-(2)将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的 Delta G

题目解答
答案
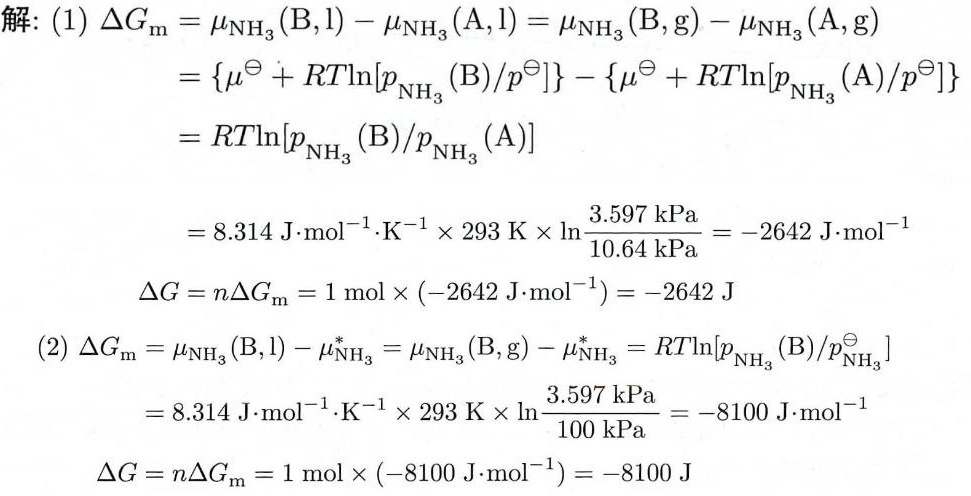
解析
步骤 1:计算从溶液A到溶液B转移1 mol NH3(g)的ΔG
根据化学势的定义,化学势μ可以表示为μ = μ° + RT ln(p/p°),其中μ°是标准化学势,R是气体常数,T是温度,p是实际分压,p°是标准压力。对于从溶液A到溶液B转移1 mol NH3(g),ΔG = μB - μA = RT ln(pB/pA)。
步骤 2:计算将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的ΔG
同样地,根据化学势的定义,将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的ΔG = μB - μ° = RT ln(pB/p°)。
根据化学势的定义,化学势μ可以表示为μ = μ° + RT ln(p/p°),其中μ°是标准化学势,R是气体常数,T是温度,p是实际分压,p°是标准压力。对于从溶液A到溶液B转移1 mol NH3(g),ΔG = μB - μA = RT ln(pB/pA)。
步骤 2:计算将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的ΔG
同样地,根据化学势的定义,将处于标准压力下的1 mol NH3(g)溶于大量的溶液B中的ΔG = μB - μ° = RT ln(pB/p°)。