P260作业题4、在一个pH为6.5、碱度为1.6 mmol/L的水体中,若加入碳酸钠,每升中需加多少的碳酸钠才能使水体pH上升至8.0。若用NaOH强碱,每升中需加多少碱?(1.07mmol/L,1.08mmol/L)
P260作业题4、在一个pH为6.5、碱度为1.6 mmol/L的水体中,若加入碳酸钠,每升中需加多少的碳酸钠才能使水体pH上升至8.0。若用NaOH强碱,每升中需加多少碱?(1.07mmol/L,1.08mmol/L)
题目解答
答案
解: pH=6.5 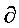 =1.710 CT1 =1.6×1.710
=1.710 CT1 =1.6×1.710 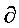 =
=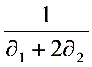
pH=8.0  =1.018 CT2=1.018×(1.6+2B)
=1.018 CT2=1.018×(1.6+2B)
加入碳酸钠时,1.6×1.710+B=1.018×(1.6+2B) C改变
B=1.069 mmol/L
加入NaOH时,1.6×1.710=1.018×(1.6+B) C不变
B=1.088 mmol/L
在一个pH为6.5碱度为1.6mmol/L水体中,若加入碳酸钠使其碱化,问需加多少mmol/L的Na2CO3才能使水体pH升至8.0.若用NaOH强碱进行碱化,又需加多少碱度?
解:总碱度=KW/ [H+] + CT(α1 + 2α2) - [H+]
CT={[总碱度] + [H+] - [OH-]}
令α= 1/(α1+ 2α2) ,当pH在5~9范围内、[碱度]≥10-3mol/L时, [H+]、[OH-]项可以忽略不计,得到简化式:CT=α[碱度]
当pH=6.5时,查表得α1=0.5845,α2=8.669×10-5,则α=1.71,CT =α[碱度]=1.71×1.6=2.736mmol/L
若加入碳酸钠将水的pH升至8.0,查表得α′=1.018,此时CT值与碱度值均有变化。设加入的碳酸钠量为Δ[CO32-],则有
CT + Δ[CO32-]=α′{[碱度] + 2Δ[CO32-]}
即2.736 + Δ[CO32-]=1.018{1.6 + 2Δ[CO32-]}
解得,Δ[CO32-]=1.069 mmol/L
若加入氢氧化钠将水的pH升至8.0,其CT值并不变化,可得:
[碱度] =CT/ α′=2.736/1.018=2.688 mmol/L
碱度增加值就是应加入的氢氧化钠强碱量:
Δ[OH-]=2.688-1.6=1.088 mmol/L
解析
根据题目,初始pH为6.5,碱度为1.6 mmol/L。在pH=6.5时,碳酸盐的分布系数α1和α2分别为0.5845和8.669×10^-5。因此,总碳酸盐浓度CT可以通过以下公式计算:
CT = α[碱度] = 1.71 × 1.6 mmol/L = 2.736 mmol/L
步骤 2:计算加入碳酸钠后的碳酸盐浓度
当pH上升至8.0时,碳酸盐的分布系数α′为1.018。设加入的碳酸钠量为Δ[CO32-],则有:
CT + Δ[CO32-] = α′{[碱度] + 2Δ[CO32-]}
将已知数值代入,得到:
2.736 + Δ[CO32-] = 1.018{1.6 + 2Δ[CO32-]}
解得,Δ[CO32-] = 1.069 mmol/L
步骤 3:计算加入NaOH后的碳酸盐浓度
当pH上升至8.0时,碳酸盐的分布系数α′为1.018。此时CT值不变,碱度值发生变化。设加入的NaOH量为Δ[OH-],则有:
[碱度] = CT / α′ = 2.736 / 1.018 = 2.688 mmol/L
碱度增加值就是应加入的氢氧化钠强碱量:
Δ[OH-] = 2.688 - 1.6 = 1.088 mmol/L