(2018·课标全国Ⅱ,13)下列实验过程可以达到实验目的的是( )编号实验目的实验过程A配制0.400 0 mol·L-1的NaOH溶液称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容B探究维生素C的还原性向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液D探究浓度对反应速率的影响向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象解析 NaOH固体溶解后需冷却至室温才能转移至250 mL容量瓶中,且需用蒸馏水洗涤烧杯内壁2~3次,洗涤液并入锥形瓶,然后定容,A项不能;实验中若观察到FeCl3溶液的黄色逐渐褪去,且溶液变成浅绿色,说明维生素C具有还原性,B项能;通过NaOH溶液可除去H2中混有的少量HCl杂质,再经浓硫酸干燥即可得到H2,没有必要经过KMnO4溶液,C项不能;NaHSO3溶液与H2O2溶液的反应没有明显实验现象,无法判断反应进行的快慢,D项不能。[思维模型]第一步:明确题干信息,掌握题目要求。属于“因果关系型”、“结论与操作相关型”、“方法原理应用型”等的哪一类型。第二步:认真阅读表格要素,明确表格各栏目信息。(1)判断原理与现象或结论解释的关系。(2)判断“目的—仪器—试剂”的合理性。(3)判断“仪器(或用品)”与“实验”的对应性。(4)判断“分离、提纯方法”与“原理”的合理性等。第三步:逐项判断,不遗漏任何信息。多用排除法、特例法等。[解题示例]实验操作及现象结论判断正误解释(1)用铂丝蘸取某溶液进行焰色反应,火焰呈黄色一定是钠盐,该溶液中一定不含有K+(2)向乙醇中加入浓硫酸,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液,溶液褪色该气体是乙烯(3)向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝溶液X中无NH(4)用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝该气体是Cl2(5)将某气体通入品红溶液中,品红溶液褪色该气体一定是SO2(6)向溶液Y中滴加硝酸,再滴加BaCl2溶液,有白色沉淀生成Y中一定含有SO(7)往CH2===CHCHO中滴入酸性KMnO4溶液,溶液褪色该有机物中含有碳碳双键(8)蘸有浓氨水的玻璃棒靠近溶液X,有白烟产生X一定是浓盐酸(9)在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2悬浊液并加热,无砖红色沉淀说明淀粉未水解(10)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色该溶液中一定含Fe2+(11)溴乙烷与NaOH溶液共热后,滴加AgNO3溶液,未出现淡黄色沉淀溴乙烷未发生水解(12)在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中,有气泡产生说明Ksp(BaCO3)<Ksp(BaSO4)(13)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,铝箔熔化但不滴落氧化铝的熔点高于铝单质(14)将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去SO2具有漂白性(15)将SO2气体通入到Ba(NO3)2溶液中,生成白色沉淀此沉淀是BaSO3(16)向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中,产生白色浑浊酸性:醋酸>碳酸>苯酚(17)将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红Fe(NO3)2晶体已氧化变质(18)SO2通入溴水(或碘水或酸性高锰酸钾溶液)中,溴水褪色SO2有漂白性(19)向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊该溶液一定是碳酸盐溶液(20)分离乙酸和乙酸乙酯用分液法(21)制备Fe(OH)3胶体:0.1 mol·L-1FeCl3溶液与0.3 mol·L-1NaOH溶液等体积混合有胶体生成(22)向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出蛋白质均发生变性答案 (1)× NaOH焰色反应火焰也是黄色,检验钾元素要透过蓝色钴玻璃,透过蓝色钴玻璃火焰呈紫色说明含有钾元素,否则不含有(2)× 未反应的乙醇、生成的乙烯、SO2都能使酸性KMnO4溶液褪色(3)× NH3极易溶于水,在溶液中加入稀NaOH溶液,生成的氨水浓度小,不加热时NH3不会挥发出来(4)× 淀粉碘化钾试纸检验的是具有强氧化性的气体,Y可能是Cl2,也可能是O3、NO2等气体(5)× O3、Cl2也能使品红溶液褪色(6)× 若溶液Y中含有SOdm,滴加硝酸时能被氧化成SOdm,加入BaCl2也会有白色沉淀产生(7)× 碳碳双键和醛基都能使酸性高锰酸钾褪色,故用KMnO4溶液无法证明分子中含有碳碳双键(8)× 只要是挥发性的浓酸遇蘸有浓氨水的玻璃棒都能产生白烟,浓盐酸、浓硝酸都符合(9)× 稀硫酸在淀粉水解中作催化剂,在未中和硫酸的情况下加入的新制Cu(OH)2悬浊液会与硫酸反应生成CuSO4,在加热时得不到沉淀,应该先加氢氧化钠中和硫酸后再加新制Cu(OH)2悬浊液(10)√ Fe2+的检验方法正确(11)× NaOH与AgNO3溶液反应生成的AgOH极不稳定,分解生成棕褐色的氧化银,干扰溴离子的检验(12)× 溶解度大的物质容易向溶解度小的转化;但Ksp相近时,溶解度小的物质也能向溶解度大的转化,如Ksp(BaSO4)<Ksp(BaCO3),但BaSO4可转化为BaCO3(13)√ 氧化铝的熔点高,像网兜一样包裹在Al的外面,铝箔熔化但不滴落(14)× 二氧化硫是酸性氧化物,能与碱反应生成盐和水,与漂白性无关(15)× H2SO3是中强酸,电离出的H+与溶液中的NOdm能将SOdm化成SOdm,故该白色沉淀是BaSO4(16)× 因醋酸具有挥发性,生成的CO2气体中混有挥发出的CH3COOH,变浑浊可能是因为CO2,也可能是因为CH3COOH,无法比较碳酸与苯酚的酸性强弱(17)× 在Fe(NO3)2中加入稀硫酸后,Fe2+能被H+、NOdm (两者同时存在相当于HNO3)氧化成Fe3+而干扰实验(18)× SO2在反应中作还原剂,体现的是还原性而不是漂白性(19)× 碳酸氢盐、亚硫酸盐、亚硫酸氢盐溶液也有相同现象(20)× 乙酸与乙酸乙酯互溶,不能用分液的方法分离(21)× 将饱和FeCl3溶液滴入沸水中,继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体(22)× 向蛋白质溶液中加入饱和氯化钠溶液,发生盐析dm dm[典例演示1] (2017·海南化学,12改编)下列实验操作错误的是( )A. 滴定前用待测液润洗锥形瓶 B. 容量瓶和滴定管使用前均需要检漏 C. 蒸馏完毕时,先停止加热再关闭冷凝水, D. 分液时,下层溶液先从下口放出,上层溶液再从上口倒出
(2018·课标全国Ⅱ,13)下列实验过程可以达到实验目的的是( )
编号
实验目的
实验过程
A
配制0.400 0 mol·L-1的NaOH溶液
称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取并纯化氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象
解析 NaOH固体溶解后需冷却至室温才能转移至250 mL容量瓶中,且需用蒸馏水洗涤烧杯内壁2~3次,洗涤液并入锥形瓶,然后定容,A项不能;实验中若观察到FeCl3溶液的黄色逐渐褪去,且溶液变成浅绿色,说明维生素C具有还原性,B项能;通过NaOH溶液可除去H2中混有的少量HCl杂质,再经浓硫酸干燥即可得到H2,没有必要经过KMnO4溶液,C项不能;NaHSO3溶液与H2O2溶液的反应没有明显实验现象,无法判断反应进行的快慢,D项不能。
[思维模型]
第一步:明确题干信息,掌握题目要求。
属于“因果关系型”、“结论与操作相关型”、“方法原理应用型”等的哪一类型。
第二步:认真阅读表格要素,明确表格各栏目信息。
(1)判断原理与现象或结论解释的关系。
(2)判断“目的—仪器—试剂”的合理性。
(3)判断“仪器(或用品)”与“实验”的对应性。
(4)判断“分离、提纯方法”与“原理”的合理性等。
第三步:逐项判断,不遗漏任何信息。
多用排除法、特例法等。
[解题示例]
实验操作及现象
结论
判断
正误
解释
(1)
用铂丝蘸取某溶液进行焰色反应,火焰呈黄色
一定是钠盐,该溶液中一定不含有K+
(2)
向乙醇中加入浓硫酸,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液,溶液褪色
该气体是乙烯
(3)
向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
溶液X中无NH
(4)
用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝
该气体是Cl2
(5)
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
(6)
向溶液Y中滴加硝酸,再滴加BaCl2溶液,有白色沉淀生成
Y中一定含有SO
(7)
往CH2===CHCHO中滴入酸性KMnO4溶液,溶液褪色
该有机物中含有碳碳双键
(8)
蘸有浓氨水的玻璃棒靠近溶液X,有白烟产生
X一定是浓盐酸
(9)
在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2悬浊液并加热,无砖红色沉淀
说明淀粉未水解
(10)
向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色
该溶液中一定含Fe2+
(11)
溴乙烷与NaOH溶液共热后,滴加AgNO3溶液,未出现淡黄色沉淀
溴乙烷未发生水解
(12)
在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中,有气泡产生
说明
Ksp(BaCO3)
<
Ksp(BaSO4)
(13)
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,铝箔熔化但不滴落
氧化铝的熔点高于铝单质
(14)
将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去
SO2具有漂白性
(15)
将SO2气体通入到Ba(NO3)2溶液中,生成白色沉淀
此沉淀是BaSO3
(16)
向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中,产生白色浑浊
酸性:醋酸>碳酸>苯酚
(17)
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红
Fe(NO3)2晶体已氧化变质
(18)
SO2通入溴水(或碘水或酸性高锰酸钾溶液)中,溴水褪色
SO2有漂白性
(19)
向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊
该溶液一定是碳酸盐溶液
(20)
分离乙酸和乙酸乙酯
用分液法
(21)
制备Fe(OH)3胶体:0.1 mol·L-1FeCl3溶液与0.3 mol·L-1NaOH溶液等体积混合
有胶体生成
(22)
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出
蛋白质均发生变性
答案 (1)× NaOH焰色反应火焰也是黄色,检验钾元素要透过蓝色钴玻璃,透过蓝色钴玻璃火焰呈紫色说明含有钾元素,否则不含有
(2)× 未反应的乙醇、生成的乙烯、SO2都能使酸性KMnO4溶液褪色
(3)× NH3极易溶于水,在溶液中加入稀NaOH溶液,生成的氨水浓度小,不加热时NH3不会挥发出来
(4)× 淀粉碘化钾试纸检验的是具有强氧化性的气体,Y可能是Cl2,也可能是O3、NO2等气体
(5)× O3、Cl2也能使品红溶液褪色
(6)× 若溶液Y中含有SO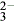 ,滴加硝酸时能被氧化成SO
,滴加硝酸时能被氧化成SO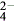 ,加入BaCl2也会有白色沉淀产生
,加入BaCl2也会有白色沉淀产生
(7)× 碳碳双键和醛基都能使酸性高锰酸钾褪色,故用KMnO4溶液无法证明分子中含有碳碳双键
(8)× 只要是挥发性的浓酸遇蘸有浓氨水的玻璃棒都能产生白烟,浓盐酸、浓硝酸都符合
(9)× 稀硫酸在淀粉水解中作催化剂,在未中和硫酸的情况下加入的新制Cu(OH)2悬浊液会与硫酸反应生成CuSO4,在加热时得不到沉淀,应该先加氢氧化钠中和硫酸后再加新制Cu(OH)2悬浊液
(10)√ Fe2+的检验方法正确
(11)× NaOH与AgNO3溶液反应生成的AgOH极不稳定,分解生成棕褐色的氧化银,干扰溴离子的检验
(12)× 溶解度大的物质容易向溶解度小的转化;但Ksp相近时,溶解度小的物质也能向溶解度大的转化,如Ksp(BaSO4)<Ksp(BaCO3),但BaSO4可转化为BaCO3
(13)√ 氧化铝的熔点高,像网兜一样包裹在Al的外面,铝箔熔化但不滴落
(14)× 二氧化硫是酸性氧化物,能与碱反应生成盐和水,与漂白性无关
(15)× H2SO3是中强酸,电离出的H+与溶液中的NO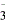 能将SO
能将SO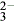 化成SO
化成SO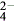 ,故该白色沉淀是BaSO4
,故该白色沉淀是BaSO4
(16)× 因醋酸具有挥发性,生成的CO2气体中混有挥发出的CH3COOH,变浑浊可能是因为CO2,也可能是因为CH3COOH,无法比较碳酸与苯酚的酸性强弱
(17)× 在Fe(NO3)2中加入稀硫酸后,Fe2+能被H+、NO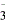 (两者同时存在相当于HNO3)氧化成Fe3+而干扰实验
(两者同时存在相当于HNO3)氧化成Fe3+而干扰实验
(18)× SO2在反应中作还原剂,体现的是还原性而不是漂白性
(19)× 碳酸氢盐、亚硫酸盐、亚硫酸氢盐溶液也有相同现象
(20)× 乙酸与乙酸乙酯互溶,不能用分液的方法分离
(21)× 将饱和FeCl3溶液滴入沸水中,继续煮沸至液体呈透明的红褐色,即得到Fe(OH)3胶体
(22)× 向蛋白质溶液中加入饱和氯化钠溶液,发生盐析

[典例演示1] (2017·海南化学,12改编)下列实验操作错误的是( )
A. 滴定前用待测液润洗锥形瓶B. 容量瓶和滴定管使用前均需要检漏
C. 蒸馏完毕时,先停止加热再关闭冷凝水,
D. 分液时,下层溶液先从下口放出,上层溶液再从上口倒出
题目解答
答案
答案 A