题目
[3.8]画出NO的分子轨道能级示意图,计算键级及自旋磁矩,试比较NO和 + 何者的键-|||-更强?哪一个键长长一些?

题目解答
答案
解析
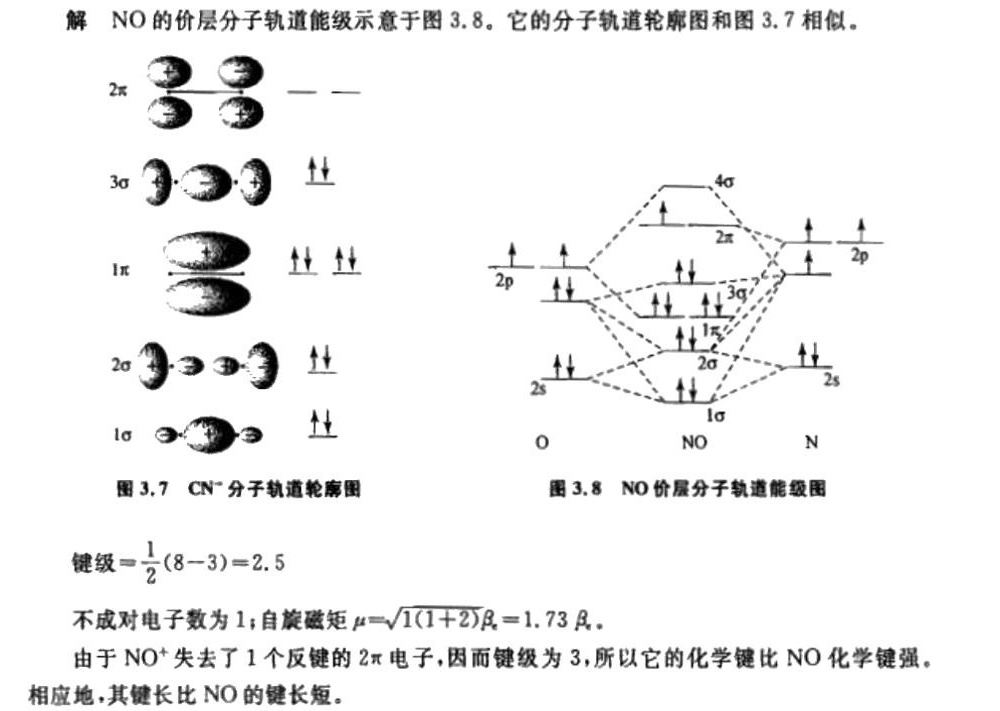
步骤 1:确定NO的分子轨道能级
NO分子由一个氮原子和一个氧原子组成。氮原子的电子构型为$1s^22s^22p^3$,氧原子的电子构型为$1s^22s^22p^4$。在分子轨道理论中,这些电子将填充分子轨道,包括σ、σ*、π和π*轨道。
步骤 2:填充分子轨道
根据分子轨道理论,电子将首先填充能量最低的轨道。对于NO分子,电子将按照以下顺序填充轨道:$1\sigma$、$1\sigma^*$、$2\sigma$、$2\sigma^*$、$2\pi$、$2\pi^*$、$3\sigma$。NO分子共有11个价电子,因此,$1\sigma$、$1\sigma^*$、$2\sigma$、$2\sigma^*$、$2\pi$、$2\pi^*$轨道将被完全填充,$3\sigma$轨道将被填充1个电子。
步骤 3:计算键级
键级是衡量分子中化学键强度的指标,计算公式为:键级 = (成键电子数 - 反键电子数) / 2。对于NO分子,成键电子数为8($1\sigma$、$2\sigma$、$2\pi$轨道),反键电子数为3($1\sigma^*$、$2\sigma^*$、$2\pi^*$轨道),因此键级 = (8 - 3) / 2 = 2.5。
步骤 4:计算自旋磁矩
自旋磁矩是衡量分子中未成对电子数的指标,计算公式为:$\mu = \sqrt{n(n+2)}\beta$,其中n为未成对电子数。对于NO分子,未成对电子数为1,因此自旋磁矩 = $\sqrt{1(1+2)}\beta = 1.73\beta$。
步骤 5:比较NO和${NO}^+$的键级和键长
${NO}^+$分子比NO分子少一个电子,因此${NO}^+$分子的键级为3,比NO分子的键级2.5更强。由于${NO}^+$分子的键级更高,因此其键长比NO分子的键长短。
NO分子由一个氮原子和一个氧原子组成。氮原子的电子构型为$1s^22s^22p^3$,氧原子的电子构型为$1s^22s^22p^4$。在分子轨道理论中,这些电子将填充分子轨道,包括σ、σ*、π和π*轨道。
步骤 2:填充分子轨道
根据分子轨道理论,电子将首先填充能量最低的轨道。对于NO分子,电子将按照以下顺序填充轨道:$1\sigma$、$1\sigma^*$、$2\sigma$、$2\sigma^*$、$2\pi$、$2\pi^*$、$3\sigma$。NO分子共有11个价电子,因此,$1\sigma$、$1\sigma^*$、$2\sigma$、$2\sigma^*$、$2\pi$、$2\pi^*$轨道将被完全填充,$3\sigma$轨道将被填充1个电子。
步骤 3:计算键级
键级是衡量分子中化学键强度的指标,计算公式为:键级 = (成键电子数 - 反键电子数) / 2。对于NO分子,成键电子数为8($1\sigma$、$2\sigma$、$2\pi$轨道),反键电子数为3($1\sigma^*$、$2\sigma^*$、$2\pi^*$轨道),因此键级 = (8 - 3) / 2 = 2.5。
步骤 4:计算自旋磁矩
自旋磁矩是衡量分子中未成对电子数的指标,计算公式为:$\mu = \sqrt{n(n+2)}\beta$,其中n为未成对电子数。对于NO分子,未成对电子数为1,因此自旋磁矩 = $\sqrt{1(1+2)}\beta = 1.73\beta$。
步骤 5:比较NO和${NO}^+$的键级和键长
${NO}^+$分子比NO分子少一个电子,因此${NO}^+$分子的键级为3,比NO分子的键级2.5更强。由于${NO}^+$分子的键级更高,因此其键长比NO分子的键长短。