题目
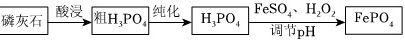
制备锂离子电池的正极材料的前体FePO4的一种流程如图:磷灰石 酸浸 粗H3PO4 纯化 H3PO4 FeSO4、H2O2 F ePO4-|||-调节pH资料:i.磷灰石的主要成分是Ca5(PO4)3Fii.Ca(H2PO4)2可溶于水,CaSO4•2H2O微溶于水iii.Ksp(FePO4)=1.3×10-22(1)酸浸制粗H3PO4用H3PO4溶液、H2SO4溶液浸取磷灰石生成HF、CaSO4•2H2O和H3PO4。①加入H3PO4溶液、H2SO4溶液的顺序为 ____ 。②写出该反应的化学方程式: ____ 。③“酸浸”时能否要浓盐酸代替硫酸? ____ (判断并说明理由)。(2)纯化制备H3PO4已知纯磷酸(熔点为42℃,沸点261℃),高于100℃时会脱水生成焦磷酸。则由85%的粗磷酸纯化制纯磷酸的实验操作为 ____ 。(3)制备FePO4①已知25℃时H3PO4电离平衡常数Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13则Na2HPO4水解平衡常数为 ____ (保留2位有效数字)。②已知:制备FePO4反应原理为Fe2(SO4)3+2Na2HPO4═2FePO4↓+2Na2SO4+H2SO4,不同pH对磷酸铁沉淀的影响如图所示。请补充以酸性FeSO4(含少量Al3+)的溶液制备较纯净的FePO4的实验方案:取一定量FeSO4溶液, ____ ,固体干燥,得到FePO4。(须使用的试剂:1mol•L-1NaOH溶液、1mol•L-1H2SO4溶液、1mol•L-1Na2HPO4溶液、3%H2O2溶液、BaCl2溶液)磷灰石 酸浸 粗H3PO4 纯化 H3PO4 FeSO4、H2O2 F ePO4-|||-调节pH
制备锂离子电池的正极材料的前体FePO4的一种流程如图:
资料:i.磷灰石的主要成分是Ca5(PO4)3F
ii.Ca(H2PO4)2可溶于水,CaSO4•2H2O微溶于水
iii.Ksp(FePO4)=1.3×10-22
(1)酸浸制粗H3PO4
用H3PO4溶液、H2SO4溶液浸取磷灰石生成HF、CaSO4•2H2O和H3PO4。
①加入H3PO4溶液、H2SO4溶液的顺序为 ____ 。
②写出该反应的化学方程式: ____ 。
③“酸浸”时能否要浓盐酸代替硫酸? ____ (判断并说明理由)。
(2)纯化制备H3PO4
已知纯磷酸(熔点为42℃,沸点261℃),高于100℃时会脱水生成焦磷酸。则由85%的粗磷酸纯化制纯磷酸的实验操作为 ____ 。
(3)制备FePO4
①已知25℃时H3PO4电离平衡常数Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13
则Na2HPO4水解平衡常数为 ____ (保留2位有效数字)。
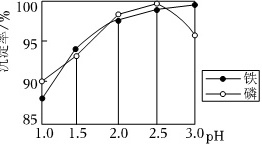
②已知:制备FePO4反应原理为Fe2(SO4)3+2Na2HPO4═2FePO4↓+2Na2SO4+H2SO4,不同pH对磷酸铁沉淀的影响如图所示。请补充以酸性FeSO4(含少量Al3+)的溶液制备较纯净的FePO4的实验方案:取一定量FeSO4溶液, ____ ,固体干燥,得到FePO4。(须使用的试剂:1mol•L-1NaOH溶液、1mol•L-1H2SO4溶液、1mol•L-1Na2HPO4溶液、3%H2O2溶液、BaCl2溶液)

资料:i.磷灰石的主要成分是Ca5(PO4)3F
ii.Ca(H2PO4)2可溶于水,CaSO4•2H2O微溶于水
iii.Ksp(FePO4)=1.3×10-22
(1)酸浸制粗H3PO4
用H3PO4溶液、H2SO4溶液浸取磷灰石生成HF、CaSO4•2H2O和H3PO4。
①加入H3PO4溶液、H2SO4溶液的顺序为 ____ 。
②写出该反应的化学方程式: ____ 。
③“酸浸”时能否要浓盐酸代替硫酸? ____ (判断并说明理由)。
(2)纯化制备H3PO4
已知纯磷酸(熔点为42℃,沸点261℃),高于100℃时会脱水生成焦磷酸。则由85%的粗磷酸纯化制纯磷酸的实验操作为 ____ 。
(3)制备FePO4
①已知25℃时H3PO4电离平衡常数Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13
则Na2HPO4水解平衡常数为 ____ (保留2位有效数字)。
②已知:制备FePO4反应原理为Fe2(SO4)3+2Na2HPO4═2FePO4↓+2Na2SO4+H2SO4,不同pH对磷酸铁沉淀的影响如图所示。请补充以酸性FeSO4(含少量Al3+)的溶液制备较纯净的FePO4的实验方案:取一定量FeSO4溶液, ____ ,固体干燥,得到FePO4。(须使用的试剂:1mol•L-1NaOH溶液、1mol•L-1H2SO4溶液、1mol•L-1Na2HPO4溶液、3%H2O2溶液、BaCl2溶液)

题目解答
答案
解:(1)①因为Ca(H2PO4)2可溶于水,(CaSO4•2H2O)微溶于水,磷灰石的主要成分是(Ca5(PO4)3F,先加入H3PO4溶液转化为可溶于水的Ca(H2PO4)2,再加入H2SO4溶液进行反应,
故答案为:先加入H3PO4溶液,再加入H2SO4溶液;
②用H3PO4溶液、H2SO4溶液浸取磷灰石生成HF、CaSO4•2H2O和H3PO4,反应的化学方程式为Ca5(PO4)3F+5H2SO4+2H2O=5CaSO4•2H2O+HF+3H3PO4,
故答案为:Ca5(PO4)3F+5H2SO4+2H2O=5CaSO4•2H2O+HF+3H3PO4;
③“酸浸”时不能用浓盐酸代替硫酸,因为氯化钙易溶于水,硫酸钙微溶于水,无法得到(CaSO4•2H2O,
故答案为:不能,因为氯化钙易溶于水,硫酸钙微溶于水,无法得到CaSO4•2H2O;
(2)过饱和溶液暂时处于亚稳态,当加入一些固体的晶体或晃动时可使此状态失去平衡,过多的溶质就会结晶,因此可向磷酸的过饱和溶液中加入磷酸晶种促进其结晶,由85%的粗磷酸纯化制纯磷酸的实验操作为减压蒸馏除水、结晶除杂,
故答案为:减压蒸馏除水、结晶除杂;
(3)①已知25℃时H3PO4电离平衡常数Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13,Na2HPO4+H2O⇌NaH2PO4+NaOH,则Na2HPO4水解平衡常数为Kh=$\frac{{K}_{w}}{{K}_{a2}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-8}}$=1.61×10-7,
故答案为:1.61×10-7;
②由题意可知,需先将亚铁离子氧化为铁离子,再加入磷酸一氢钠调节pH为2.5使沉淀率最高,因此补充实验方案为:加入足量的3%双氧水溶液,充分反应,使FeSO4溶液全部被氧化为Fe2(SO4)3溶液,边搅拌边将1mol⋅L-1Na2HPO4溶液缓慢加入到Fe2(SO4)3溶液中,至溶液的pH约为2.5,过滤,洗涤至最后一次洗涤液加入BaCl2溶液无沉淀出现,
故答案为:加入足量的3%双氧水溶液,充分反应,使FeSO4溶液全部被氧化为Fe2(SO4)3溶液,边搅拌边将1mol⋅L-1Na2HPO4溶液缓慢加入到Fe2(SO4)3溶液中,至溶液的pH约为2.5,过滤,洗涤至最后一次洗涤液加入BaCl2溶液无沉淀出现。
故答案为:先加入H3PO4溶液,再加入H2SO4溶液;
②用H3PO4溶液、H2SO4溶液浸取磷灰石生成HF、CaSO4•2H2O和H3PO4,反应的化学方程式为Ca5(PO4)3F+5H2SO4+2H2O=5CaSO4•2H2O+HF+3H3PO4,
故答案为:Ca5(PO4)3F+5H2SO4+2H2O=5CaSO4•2H2O+HF+3H3PO4;
③“酸浸”时不能用浓盐酸代替硫酸,因为氯化钙易溶于水,硫酸钙微溶于水,无法得到(CaSO4•2H2O,
故答案为:不能,因为氯化钙易溶于水,硫酸钙微溶于水,无法得到CaSO4•2H2O;
(2)过饱和溶液暂时处于亚稳态,当加入一些固体的晶体或晃动时可使此状态失去平衡,过多的溶质就会结晶,因此可向磷酸的过饱和溶液中加入磷酸晶种促进其结晶,由85%的粗磷酸纯化制纯磷酸的实验操作为减压蒸馏除水、结晶除杂,
故答案为:减压蒸馏除水、结晶除杂;
(3)①已知25℃时H3PO4电离平衡常数Ka1=6.9×10-3、Ka2=6.2×10-8、Ka3=4.8×10-13,Na2HPO4+H2O⇌NaH2PO4+NaOH,则Na2HPO4水解平衡常数为Kh=$\frac{{K}_{w}}{{K}_{a2}}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-8}}$=1.61×10-7,
故答案为:1.61×10-7;
②由题意可知,需先将亚铁离子氧化为铁离子,再加入磷酸一氢钠调节pH为2.5使沉淀率最高,因此补充实验方案为:加入足量的3%双氧水溶液,充分反应,使FeSO4溶液全部被氧化为Fe2(SO4)3溶液,边搅拌边将1mol⋅L-1Na2HPO4溶液缓慢加入到Fe2(SO4)3溶液中,至溶液的pH约为2.5,过滤,洗涤至最后一次洗涤液加入BaCl2溶液无沉淀出现,
故答案为:加入足量的3%双氧水溶液,充分反应,使FeSO4溶液全部被氧化为Fe2(SO4)3溶液,边搅拌边将1mol⋅L-1Na2HPO4溶液缓慢加入到Fe2(SO4)3溶液中,至溶液的pH约为2.5,过滤,洗涤至最后一次洗涤液加入BaCl2溶液无沉淀出现。