牙膏是常见的日用化学品。(1)下表列出了两种牙膏中的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。摩擦剂碳酸钙二氧化硅物质类别(2)请根据用途推测并说明二氧化硅在水中的溶解性(“易溶”或“难溶”)。(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。①甲同学设计了一种在实验室中制备碳酸钙的实验方案(如下所示),请写出下述方案中有关反应的化学方程式。加入水 熟石灰 加入Na2 CO3溶液-|||-石灰石 高温 生石灰 碳酸钙②乙同学设计的实验方案为:加入水 熟石灰 加入Na2 CO3溶液-|||-石灰石 高温 生石灰 碳酸钙乙同学的实验方案与甲同学的相比,有哪些优点?请写出乙同学的方案中有关反应的离子方程式。
牙膏是常见的日用化学品。
(1)下表列出了两种牙膏中的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。
摩擦剂 | 碳酸钙 | 二氧化硅 |
物质类别 |
(2)请根据用途推测并说明二氧化硅在水中的溶解性(“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
①甲同学设计了一种在实验室中制备碳酸钙的实验方案(如下所示),请写出下述方案中有关反应的化学方程式。

②乙同学设计的实验方案为:
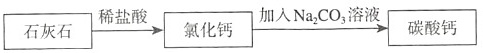
乙同学的实验方案与甲同学的相比,有哪些优点?请写出乙同学的方案中有关反应的离子方程式。
题目解答
答案
【解析】
(1)碳酸钙属于盐,二氧化硅属于氧化物;
故答案为:
摩擦剂 | 碳酸钙 | 二氧化硅 |
物质类别 | 盐 | 氧化物 |
(2)摩擦剂是通过摩擦除去牙齿上的残留食物,因此二氧化硅在水中应为难溶氧化物;
故答案为:难溶;
(3)①石灰石在高温下分解成生石灰和二氧化碳,化学方程式为$CaC{O}_{3}\xlongequal[\,]{\mathrm{高温}}CaO+C{O}_{2}\uparrow $;生石灰与水反应生成熟石灰,化学方程式为$\mathrm{CaO}+{\mathrm{H}}_{2}\mathrm{O}=\!=\!=\mathrm{Ca}{\left(\mathrm{OH}\right)}_{2}$;熟石灰与碳酸钠反应生成碳酸钙,化学方程式为$\mathrm{Ca}{\left(\mathrm{OH}\right)}_{2}+{\mathrm{Na}}_{2}{\mathrm{CO}}_{3}=\!=\!={\mathrm{CaCO}}_{3}\downarrow +2\mathrm{NaOH}$;
故答案为:$CaC{O}_{3}\xlongequal[\,]{\mathrm{高温}}CaO+C{O}_{2}\uparrow $;$\mathrm{CaO}+{\mathrm{H}}_{2}\mathrm{O}=\!=\!=\mathrm{Ca}{\left(\mathrm{OH}\right)}_{2}$;$\mathrm{Ca}{\left(\mathrm{OH}\right)}_{2}+{\mathrm{Na}}_{2}{\mathrm{CO}}_{3}=\!=\!={\mathrm{CaCO}}_{3}\downarrow +2\mathrm{NaOH}$;
②乙同学的实验方案与甲同学的相比,消耗能源少、步骤简单、反应条件要求低;
石灰石与稀盐酸反应生成氯化钙,离子方程式为$\mathrm{C}{\mathrm{aCO}}_{3}+2{\mathrm{H}}^{+}=\!=\!={\mathrm{C}\mathrm{a}}^{2+}+{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\uparrow $;氯化钙与碳酸钠反应生成碳酸钙,离子方程式为${\mathrm{Ca}}^{2+}+{\mathrm{C}\mathrm{O}}_{3}^{2-}=\!=\!={\mathrm{CaCO}}_{3}\downarrow $;
故答案为:消耗能源少、步骤简单、反应条件要求低;$\mathrm{C}{\mathrm{aCO}}_{3}+2{\mathrm{H}}^{+}=\!=\!={\mathrm{C}\mathrm{a}}^{2+}+{\mathrm{H}}_{2}\mathrm{O}+{\mathrm{CO}}_{2}\uparrow $;${\mathrm{Ca}}^{2+}+{\mathrm{C}\mathrm{O}}_{3}^{2-}=\!=\!={\mathrm{CaCO}}_{3}\downarrow $
【答案】
(1)
摩擦剂 | 碳酸钙 | 二氧化硅 |
物质类别 | 盐 | 氧化物 |
(2)难溶
(3)①$CaC{O}_{3}\xlongequal[\,]{\mathrm{高温}}CaO+C{O}_{2}\uparrow $;$\mathrm{CaO}+{\mathrm{H}}_{2}\mathrm{O}=\!=\!=\mathrm{Ca}{\left(\mathrm{OH}\right)}_{2}$;
解析
- 物质分类:根据化合物组成判断类别,盐由金属阳离子(或铵根)和酸根组成,氧化物由两种元素组成且含氧。
- 溶解性推断:结合摩擦剂的作用(摩擦作用去除污垢),推测二氧化硅在水中是否溶解。
- 化学反应与方案优化:石灰石制备碳酸钙的两种路径,对比反应条件、步骤复杂度;离子方程式需体现反应本质。
第(1)题
- 碳酸钙(CaCO₃):含钙阳离子和碳酸根,属于盐。
- 二氧化硅(SiO₂):由硅和氧组成,属于氧化物。
第(2)题
- 牙膏摩擦剂通过摩擦作用清洁牙齿,若二氧化硅易溶则会溶解于口腔中的唾液,无法有效摩擦。因此推断其难溶于水。
第(3)题
①甲同学的实验方案
石灰石分解
石灰石(主要成分碳酸钙)高温分解生成氧化钙和二氧化碳:
$\mathrm{CaCO_3} \xlongequal{\text{高温}} \mathrm{CaO} + \mathrm{CO_2}\uparrow$
生石灰变成熟石灰
氧化钙与水反应生成氢氧化钙:
$\mathrm{CaO} + \mathrm{H_2O} \rightarrow \mathrm{Ca(OH)_2}$
熟石灰与碳酸钠反应
氢氧化钙与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠:
$\mathrm{Ca(OH)_2} + \mathrm{Na_2CO_3} \rightarrow \mathrm{CaCO_3}\downarrow + 2\mathrm{NaOH}$
②乙同学的实验方案
优点对比
- 无需高温煅烧(直接用石灰石与盐酸反应)
- 步骤更简单(减少分解、熟化步骤)
- 反应条件更温和
离子方程式
- 石灰石与稀盐酸反应:
$\mathrm{CaCO_3} + 2\mathrm{H^+} \rightarrow \mathrm{Ca^{2+}} + \mathrm{H_2O} + \mathrm{CO_2}\uparrow$ - 氯化钙与碳酸钠反应:
$\mathrm{Ca^{2+}} + \mathrm{CO_3^{2-}} \rightarrow \mathrm{CaCO_3}\downarrow$