题目
在总压101.3kPa,温度30℃的条件下, SO2摩尔分率为0.3的混合气体与SO2摩尔分率为0.01的水溶液相接触,试问:(1) 从液相分析SO2的传质方向;(2) 从气相分析,其他条件不变,温度降到0℃时SO2的传质方向;(3) 其他条件不变,从气相分析,总压提高到202.6kPa时SO2的传质方向,并计算以液相摩尔分率差及气相摩尔率差表示的传质推动力。
在总压101.3kPa,温度30℃的条件下, SO2摩尔分率为0.3的混合气体与SO2摩尔分率为0.01的水溶液相接触,试问:
(1) 从液相分析SO2的传质方向;
(2) 从气相分析,其他条件不变,温度降到0℃时SO2的传质方向;
(3) 其他条件不变,从气相分析,总压提高到202.6kPa时SO2的传质方向,并计算以液相摩尔分率差及气相摩尔率差表示的传质推动力。
题目解答
答案
解:(1)查得在总压101.3kPa,温度30℃条件下SO2在水中的亨利系数E=4850kPa
所以 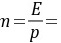
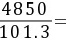 47.88
47.88
从液相分析
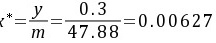 < x=0.01
< x=0.01
故SO2必然从液相转移到气相,进行解吸过程。
(2)查得在总压101.3kPa,温度0℃的条件下,SO2在水中的亨利系数E=1670kPa
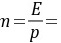
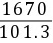 =16.49
=16.49
从气相分析
y*=mx=16.49×0.01=0.16<y=0.3
故SO2必然从气相转移到液相,进行吸收过程。
(3)在总压202.6kPa,温度30℃条件下,SO2在水中的亨利系数E=4850kPa
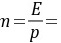
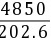 =23.94
=23.94
从气相分析
y*=mx=23.94×0.01=0.24<y=0.3
故SO2必然从气相转移到液相,进行吸收过程。
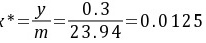
以液相摩尔分数表示的吸收推动力为:
∆x=x*-x=0.0125-0.01=0.0025
以气相摩尔分数表示的吸收推动力为:
∆y= y - y*=0.3-0.24=0.06
扩散与单相传质
解析
本题考查气体在液体中的传质方向判断及推动力计算,核心在于相平衡关系的应用。关键点如下:
- 亨利定律:$y = \frac{E}{P}x$,其中$E$为亨利系数,$P$为总压,$y$和$x$分别为气、液相中溶质的摩尔分率。
- 相平衡常数:$m = \frac{E}{P}$,用于关联气液两相的平衡分率。
- 传质方向判断:
- 从液相分析:若实际液相分率$x > x^*$(平衡分率),则解吸;反之吸收。
- 从气相分析:若实际气相分率$y > y^*$,则吸收;反之解吸。
- 推动力计算:根据相平衡关系,计算液相分率差$\Delta x = x^* - x$或气相分率差$\Delta y = y - y^*$。
第(1)题
- 计算相平衡常数:
$m = \frac{E}{P} = \frac{4850}{101.3} \approx 47.88$ - 求液相平衡分率:
$x^* = \frac{y}{m} = \frac{0.3}{47.88} \approx 0.00627$ - 比较分率:
实际液相分率$x = 0.01 > x^* = 0.00627$,故SO₂从液相转移到气相,解吸。
第(2)题
- 计算相平衡常数:
$m = \frac{E}{P} = \frac{1670}{101.3} \approx 16.49$ - 求气相平衡分率:
$y^* = m x = 16.49 \times 0.01 = 0.16$ - 比较分率:
实际气相分率$y = 0.3 > y^* = 0.16$,故SO₂从气相转移到液相,吸收。
第(3)题
- 计算相平衡常数:
$m = \frac{E}{P} = \frac{4850}{202.6} \approx 23.94$ - 求气相平衡分率:
$y^* = m x = 23.94 \times 0.01 = 0.24$ - 比较分率:
实际气相分率$y = 0.3 > y^* = 0.24$,故SO₂从气相转移到液相,吸收。 - 计算推动力:
- 液相分率差:$\Delta x = x^* - x = \frac{0.3}{23.94} - 0.01 \approx 0.0025$
- 气相分率差:$\Delta y = y - y^* = 0.3 - 0.24 = 0.06$