5.可逆一级液相反应 A=P, 已知 _(AO)=0.5kmolcdot (m)^-3 ,cp0=0; 当此反应在间歇反应器中-|||-进行,经过8min后,A的转化率为33.3%,而平衡转化率是66.7 %,求此反应的动力学方程式。

题目解答
答案
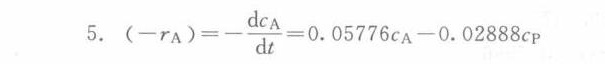
解析
本题考察可逆一级液相反应的动力学方程式推导,关键是利用间歇反应器中浓度随时间的变化关系及平衡条件求解正、逆反应速率常数。
步骤1:反应动力学方程的一般形式
可逆一级液相反应 $A \rightleftharpoons P \$ 的动力学方程可表示为:
$-r_A = k_1 c_A - k_{-1} c_P$
其中,$k_1$ 为正反应速率常数,$k_{-1}$ 逆反应速率常数,$c_A$、$c_P$ ) 分别为A、P的浓度。
步骤2:浓度与转化率的关系
初始条件:$c_{A_0 = 0.5 \, \text{kmol·m}^{-3}$,$c_{P0} = 0$,转化率$x_A$定义为: $c_A = c_{A0}(1 - x_A),\quad c_P = c_{A0}x_A$
步骤3:利用平衡转化率求$K$
平衡时$-r_A=0$,平衡转化率$x_{Ae}=0.667$,则: $K = \frac{k_1}{k_{-1}} = \frac{c_{Pe}}{c_{Ae}} = \frac{x_{Ae}}{1 - x_{Ae} = \frac{0.667}{1 - 0.667} \approx 2.001$
步骤4:积分速率方程求解$k_1$
间歇反应器中$-r_A = \frac{dc_A}{dt}$,代入浓度表达式得:
$\int_{0}^{t} dt = \int_{c_{A0}}^{c_A} \frac{dc_A}{k_1 c_A - k_{-1}(c_{A0} - c_A)}$
化简后积分结果为:
$t = \frac{1}{k_1 + k_{-1}} \ln\left( \frac{k_1 c_{A0} + k_{-1} c_{A0}}{k_1 c_{A0} + k_{-1} c_A} \right)$
代入$t=8\,\text{min}$,$x_A=0.333$($c_A=0.333\,\text{kmol·m}^{-3}$),$K=2.001$,解得:
$k_1 \approx 0.05776\,\text{min}^{-1},\quad k_{-1} \approx 0.02888\,\text{min}^{-1}$
最终动力学方程
[ -r_A = 0.05776c_A - 0.02888c_P