题目
9.在298K时,已知 .10molcdot (L)^-1 的某一元弱酸水溶液的pH为3.00,试计算:-|||-(1)该酸的解离常数K-|||-(2)该酸的解离度α;-|||-(3)将该酸溶液稀释一倍后的α及pH。

题目解答
答案
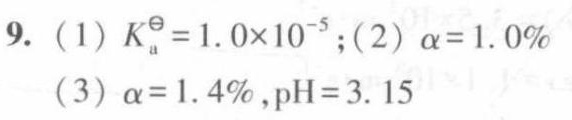
解析
考查要点:本题主要考查弱酸的解离平衡计算,涉及解离常数、解离度的计算,以及稀释对解离度和pH的影响。
解题核心思路:
- 解离常数Ka:利用弱酸溶液的浓度和pH,通过公式 $K_a = \frac{[H^+]^2}{c(1-\alpha)}$ 近似计算(假设解离度α很小)。
- 解离度α:根据定义 $\alpha = \frac{[H^+]}{\sqrt{c K_a}}$ 或直接由 $\alpha = \frac{[H^+]}{c}$ 近似计算。
- 稀释后的α和pH:稀释导致浓度降低,解离度增大,需重新计算α,并通过 $[H^+] = c\alpha$ 计算pH。
破题关键点:
- 近似条件的判断:当解离度α较小时,可用 $K_a \approx \frac{[H^+]^2}{c}$ 简化计算;当稀释后α增大时,需解二次方程精确计算。
- 稀释规律:稀释促进解离,但[H+]的变化幅度小于浓度变化幅度,导致pH变化小于1个单位。
(1) 计算解离常数 $K_a^\theta$
- 确定[H+]:
由题意,$pH = 3.00$,故 $[H^+] = 10^{-3} \, \text{mol/L}$。 - 建立解离平衡关系:
对于一元弱酸 $HA \rightleftharpoons H^+ + A^-$,假设解离度为$\alpha$,则:
$[H^+] = \sqrt{K_a \cdot c}$
代入 $c = 0.10 \, \text{mol/L}$ 和 $[H^+] = 10^{-3}$,得:
$K_a = \frac{[H^+]^2}{c} = \frac{(10^{-3})^2}{0.10} = 1.0 \times 10^{-5}.$
(2) 计算解离度α
- 直接计算:
解离度定义为 $\alpha = \frac{[H^+]}{\sqrt{c K_a}}$,代入已知值:
$\alpha = \frac{10^{-3}}{\sqrt{0.10 \cdot 1.0 \times 10^{-5}}} = \frac{10^{-3}}{10^{-3}} = 1.0\%.$
(3) 稀释后的α和pH
- 稀释后浓度:
稀释一倍后,浓度 $c' = 0.05 \, \text{mol/L}$。 - 解二次方程求α:
由 $K_a = \frac{c' \alpha^2}{1 - \alpha}$,代入 $K_a = 1.0 \times 10^{-5}$,得:
$0.05 \alpha^2 = 1.0 \times 10^{-5} (1 - \alpha).$
解得 $\alpha \approx 1.4\%$。 - 计算pH:
$[H^+] = c' \cdot \alpha = 0.05 \cdot 0.014 = 7.0 \times 10^{-4} \, \text{mol/L},$
$pH = -\log(7.0 \times 10^{-4}) \approx 3.15.$