题目
计算298K下反应的平衡常数。若反应开始时,[Pb2+]=2.0mol.L-1,平衡时[Pb2+]和[Sn2+]的浓度各是多少?(E(Pb2+/Pb)=-0.126;E(Sn2+/Sn)=-0.136)
计算298K下反应的平衡常数。若反应开始时,[Pb2+]=2.0mol.L-1,平衡时[Pb2+]和[Sn2+]的浓度各是多少?(E(Pb2+/Pb)=-0.126;E(Sn2+/Sn)=-0.136)
题目解答
答案
解:
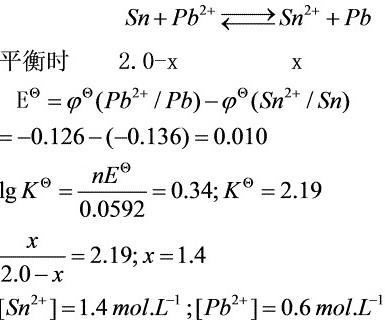
解析
步骤 1:确定反应方程式
反应方程式为:${Sn}^{2+} + {Pb}^{2+} \rightleftharpoons {Sn}^{4+} + {Pb}$
步骤 2:计算标准电极电势
根据给定的电极电势,计算反应的标准电极电势:
$E_{cell} = E_{cathode} - E_{anode} = E({Pb}^{2+}/{Pb}) - E({Sn}^{2+}/{Sn}) = -0.126 - (-0.136) = 0.010 V$
步骤 3:计算平衡常数
利用能斯特方程计算平衡常数:
$\lg K = \frac{7E_{cell}}{0.0592} = \frac{7 \times 0.010}{0.0592} = 0.34$
$K = 10^{0.34} = 2.19$
步骤 4:计算平衡时的浓度
设平衡时${Pb}^{2+}$的浓度为$2.0 - x$,${Sn}^{2+}$的浓度为$x$,则有:
$\frac{x}{2.0 - x} = 2.19$
解得:$x = 1.4$
反应方程式为:${Sn}^{2+} + {Pb}^{2+} \rightleftharpoons {Sn}^{4+} + {Pb}$
步骤 2:计算标准电极电势
根据给定的电极电势,计算反应的标准电极电势:
$E_{cell} = E_{cathode} - E_{anode} = E({Pb}^{2+}/{Pb}) - E({Sn}^{2+}/{Sn}) = -0.126 - (-0.136) = 0.010 V$
步骤 3:计算平衡常数
利用能斯特方程计算平衡常数:
$\lg K = \frac{7E_{cell}}{0.0592} = \frac{7 \times 0.010}{0.0592} = 0.34$
$K = 10^{0.34} = 2.19$
步骤 4:计算平衡时的浓度
设平衡时${Pb}^{2+}$的浓度为$2.0 - x$,${Sn}^{2+}$的浓度为$x$,则有:
$\frac{x}{2.0 - x} = 2.19$
解得:$x = 1.4$