题目
4.物质分离提纯的几个重要应用(c )-|||-(1)海带中碘元素的分离-|||-海带样品灼烧后,灰分中加水后,碘元素以 __ 的形式进-|||-入溶液,利用适量新制氯水或双氧水等氧化剂将 __-|||-转化-|||-为I2,用 __ 检验I2,用 __ 萃取并 __ 来分-|||-离I2。-|||-(2)硝酸钾晶体的制备-|||-①原理:NaNO3、KNO3、NaCl、KCl四种盐的溶解度在不同-|||-温度下的差别是非常显著的。NaCl的溶解度随温度变化-|||-不大,NaNO3、KCl有明显变化,而硝酸钾的溶解度随温度-|||-的升高急剧增大。-|||-②方法和操作-|||-NaNO3和KCl 加热浓缩 溶剂减少 因NaCl溶解度-|||-的混合液 随温度变化小-|||-析出NaCl晶体 趁热过滤 含大量KNO3、少-|||-量NaCl的混合液-|||-冷却至室温,KNO 3 析出KNO3晶体 减压过滤-|||-溶解度急剧降低-|||-KNO3粗产品 重结晶 较纯KNO3晶体-|||-(含NaCl杂质)

题目解答
答案
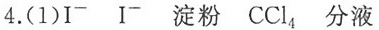
解析
步骤 1:海带中碘元素的分离
海带样品经过灼烧后,灰分中加水,碘元素以 ${I}^{-}$ 的形式进入溶液。利用适量新制氯水或双氧水等氧化剂将 ${I}^{-}$ 转化为I2。用淀粉检验I2,用CCl4萃取并分液来分离I2。
步骤 2:硝酸钾晶体的制备
NaNO3、KNO3、NaCl、KCl四种盐的溶解度在不同温度下的差别是非常显著的。NaCl的溶解度随温度变化不大,NaNO3、KCl有明显变化,而硝酸钾的溶解度随温度的升高急剧增大。NaNO3和KCl的混合液加热浓缩,溶剂减少,因NaCl溶解度随温度变化小,析出NaCl晶体。趁热过滤后,含大量KNO3、少量NaCl的混合液冷却至室温,KNO3溶解度急剧降低,析出KNO3晶体。减压过滤后得到KNO3粗产品,再通过重结晶得到较纯KNO3晶体(含NaCl杂质)。
海带样品经过灼烧后,灰分中加水,碘元素以 ${I}^{-}$ 的形式进入溶液。利用适量新制氯水或双氧水等氧化剂将 ${I}^{-}$ 转化为I2。用淀粉检验I2,用CCl4萃取并分液来分离I2。
步骤 2:硝酸钾晶体的制备
NaNO3、KNO3、NaCl、KCl四种盐的溶解度在不同温度下的差别是非常显著的。NaCl的溶解度随温度变化不大,NaNO3、KCl有明显变化,而硝酸钾的溶解度随温度的升高急剧增大。NaNO3和KCl的混合液加热浓缩,溶剂减少,因NaCl溶解度随温度变化小,析出NaCl晶体。趁热过滤后,含大量KNO3、少量NaCl的混合液冷却至室温,KNO3溶解度急剧降低,析出KNO3晶体。减压过滤后得到KNO3粗产品,再通过重结晶得到较纯KNO3晶体(含NaCl杂质)。