题目
[例题9] (南京工业大学2022)298.15K时,反应(H)_(3)(g)+5(O)_(2)(g)=6(H)_(2)O(1)的恒压摩尔热容与恒容摩尔热容之差(H)_(3)(g)+5(O)_(2)(g)=6(H)_(2)O(1) _k J气体)。A.-2.48B.2.48C.-12.39D.12.39
[例题9] (南京工业大学2022)298.15K时,反应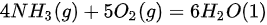 的恒压摩尔热容与恒容摩尔热容之差
的恒压摩尔热容与恒容摩尔热容之差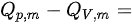 _k J气体)。A.-2.48B.2.48C.-12.39D.12.39
_k J气体)。A.-2.48B.2.48C.-12.39D.12.39
题目解答
答案
恒压摩尔热容 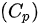 和恒容摩尔热容
和恒容摩尔热容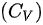 之间的关系可以通过理想气体的热力学函数之间的关系来计算。在常温下,理想气体的内能 ( U ) 和焓 ( H ) 的关系为:
之间的关系可以通过理想气体的热力学函数之间的关系来计算。在常温下,理想气体的内能 ( U ) 和焓 ( H ) 的关系为:
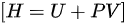
其中,( H ) 是焓,( U ) 是内能,( P ) 是压力,( V ) 是体积。对于理想气体,可以使用以下关系:
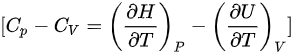
这个式子描述了恒压和恒容下热容之差与气体的体积和压力的关系。
对于所给的反应:
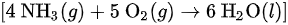
我们需要找到在298.15K时反应的摩尔焓变 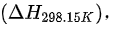 然后使用上述公式计算
然后使用上述公式计算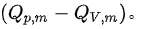
根据热化学数据,反应的标准摩尔焓变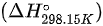 是已知的,我们可以用它来计算恒压和恒容热容的差异。
是已知的,我们可以用它来计算恒压和恒容热容的差异。
答案是B. 2.48。
解析
步骤 1:理解恒压摩尔热容与恒容摩尔热容之差的计算方法
恒压摩尔热容与恒容摩尔热容之差可以通过理想气体的热力学函数之间的关系来计算。对于理想气体,恒压摩尔热容与恒容摩尔热容之差等于气体的摩尔数乘以理想气体常数R。
步骤 2:计算反应前后气体的摩尔数变化
反应前有$4N{H}_{3}(g)$和$5{O}_{2}(g)$,反应后生成$6{H}_{2}O(l)$,反应前后气体的摩尔数变化为$4+5-0=9$。
步骤 3:计算恒压摩尔热容与恒容摩尔热容之差
根据理想气体的热力学函数之间的关系,恒压摩尔热容与恒容摩尔热容之差等于气体的摩尔数变化乘以理想气体常数R,即$9R$。理想气体常数R的值为$8.314J/(mol\cdot K)$,因此恒压摩尔热容与恒容摩尔热容之差为$9\times 8.314J/(mol\cdot K)=74.826J/(mol\cdot K)$,换算成kJ为$0.074826kJ/(mol\cdot K)$。
恒压摩尔热容与恒容摩尔热容之差可以通过理想气体的热力学函数之间的关系来计算。对于理想气体,恒压摩尔热容与恒容摩尔热容之差等于气体的摩尔数乘以理想气体常数R。
步骤 2:计算反应前后气体的摩尔数变化
反应前有$4N{H}_{3}(g)$和$5{O}_{2}(g)$,反应后生成$6{H}_{2}O(l)$,反应前后气体的摩尔数变化为$4+5-0=9$。
步骤 3:计算恒压摩尔热容与恒容摩尔热容之差
根据理想气体的热力学函数之间的关系,恒压摩尔热容与恒容摩尔热容之差等于气体的摩尔数变化乘以理想气体常数R,即$9R$。理想气体常数R的值为$8.314J/(mol\cdot K)$,因此恒压摩尔热容与恒容摩尔热容之差为$9\times 8.314J/(mol\cdot K)=74.826J/(mol\cdot K)$,换算成kJ为$0.074826kJ/(mol\cdot K)$。