金属铅具有良好的延展性、抗腐蚀性,易与其他金属制成性能优良的合金,其化合物广泛应用于蓄电池、机械制造、船舶制造、射线防护等行业。 (1)在古代,人们曾用铅作笔。“铅笔”这名字便是从这儿来的。由此知铅的硬度 (填“较大”或“较小”)。 (2)以方铅矿为原料冶炼铅的两个反应为: ①2PbS(s)+3O2(g)2PbO(s)+2SO2(g) ΔH=a kJ·mol-1 ②PbS(s)+2PbO(s)3Pb(s)+SO2(g) ΔH=b kJ·mol-1 又知:③2CO(g)+O2(g)2CO2(g) ΔH=c kJ·mol-1 则用CO还原PbO得到单质铅的热化学方程式为 。 (3)室温下,向一定浓度的硝酸铅溶液中加入足量的金属锡后,测得溶液中某种离子的浓度[用c(R2+)表示]随时间的变化情况如图所示: ①a、b两点中生成Sn2+的速率较大的是 。 ②测得该温度下Pb2+(aq)+Sn(s)Pb(s)+Sn2+(aq)的平衡常数K=2,则Pb2+的平衡转化率为 。 ③温度不变,若t2 s时向容器中加蒸馏水至溶液体积为原来的2倍,则平衡时c(Sn2+)= ;若t2 s时向容器中加入等体积的由x mol·L-1 Pb(NO3)2和1.6 mol·L-1 Sn(NO3)2组成的混合溶液,要使平衡向左移动,则x的取值范围为 。 (4)PbO2、Pb是铅蓄电池的电极材料,则放电时负极的电极反应式为 ,当电路中有2 mol电子转移时,正极的质量变化为 g。(假设生成的固体全部附着在电极上)
金属铅具有良好的延展性、抗腐蚀性,易与其他金属制成性能优良的合金,其化合物广泛应用于蓄电池、机械制造、船舶制造、射线防护等行业。
(1)在古代,人们曾用铅作笔。“铅笔”这名字便是从这儿来的。由此知铅的硬度 (填“较大”或“较小”)。
(2)以方铅矿为原料冶炼铅的两个反应为:
①2PbS(s)+3O2(g) 2PbO(s)+2SO2(g) ΔH=a kJ·mol-1
2PbO(s)+2SO2(g) ΔH=a kJ·mol-1
②PbS(s)+2PbO(s) 3Pb(s)+SO2(g) ΔH=b kJ·mol-1
3Pb(s)+SO2(g) ΔH=b kJ·mol-1
又知:③2CO(g)+O2(g) 2CO2(g) ΔH=c kJ·mol-1
2CO2(g) ΔH=c kJ·mol-1
则用CO还原PbO得到单质铅的热化学方程式为 。
(3)室温下,向一定浓度的硝酸铅溶液中加入足量的金属锡后,测得溶液中某种离子的浓度[用c(R2+)表示]随时间的变化情况如图所示:
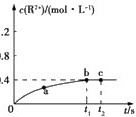
①a、b两点中生成Sn2+的速率较大的是 。
②测得该温度下Pb2+(aq)+Sn(s) Pb(s)+Sn2+(aq)的平衡常数K=2,则Pb2+的平衡转化率为 。
Pb(s)+Sn2+(aq)的平衡常数K=2,则Pb2+的平衡转化率为 。
③温度不变,若t2 s时向容器中加蒸馏水至溶液体积为原来的2倍,则平衡时c(Sn2+)= ;若t2 s时向容器中加入等体积的由x mol·L-1 Pb(NO3)2和1.6 mol·L-1 Sn(NO3)2组成的混合溶液,要使平衡向左移动,则x的取值范围为 。
(4)PbO2、Pb是铅蓄电池的电极材料,则放电时负极的电极反应式为 ,当电路中有2 mol电子转移时,正极的质量变化为 g。(假设生成的固体全部附着在电极上)
题目解答
答案
(1)较小
(2)CO(g)+PbO(s) Pb(s)+CO2(g) ΔH=
Pb(s)+CO2(g) ΔH= (2b+3c-a) kJ·mol-1
(2b+3c-a) kJ·mol-1
(3)①a ②66.7% ③0.2 mol·L-1 x<0.8
(4)Pb-2e-+S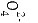
 PbSO4 增加64
PbSO4 增加64
解析
铅具有良好的延展性,可以被制成笔,说明铅的硬度较小。
【答案】
较小
(2)步骤 1:热化学方程式的计算
根据热化学方程式①、②、③,通过加减运算得到CO还原PbO得到单质铅的热化学方程式。
【答案】
CO(g)+PbO(s)Pb(s)+CO_2(g) ΔH=(2b+3c-a) kJ·mol^{-1}
(3)步骤 1:速率的比较
a点的浓度变化率大于b点,说明a点的生成速率较大。
【答案】
a
步骤 2:平衡转化率的计算
根据平衡常数K=2,计算出Pb^{2+}的平衡转化率为66.7%。
【答案】
66.7%
步骤 3:平衡移动的分析
加蒸馏水至溶液体积为原来的2倍,平衡不移动,c(Sn^{2+})=0.2 mol·L^{-1};加入等体积的由x mol·L^{-1} Pb(NO_3)_2和1.6 mol·L^{-1} Sn(NO_3)_2组成的混合溶液,要使平衡向左移动,x<0.8。
【答案】
0.2 mol·L^{-1} x<0.8
(4)步骤 1:电极反应式的书写
根据铅蓄电池的电极材料,写出放电时负极的电极反应式。
【答案】
Pb-2e^{-}+SPbSO_4
步骤 2:质量变化的计算
根据电极反应式,计算出当电路中有2 mol电子转移时,正极的质量变化为增加64g。