①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵16、A.Fe3+与SCN-在同一溶液中生成红色溶液,不能大量共存,故A错误;B.Na+、K+、AlO2-、CO32-彼此间不发生离子反应,可大量共存于碱性溶液中,故B正确;C.在能使酚酞试剂变红的溶液显碱性,NH4+、Al3+均不能在碱性溶液中大量存在,故C错误;D.Fe2+在酸性条件下能被NO3-氧化,故D错误;答案为B。 点睛:离子反应发生的条件,主要是离子间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,通常可熟记常见的易错的一些离子反应,如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存等;易错选项A中忽视溶液中已经存在的Fe3+与SCN-之间的配合反应。17、A.二氧化硅是酸性氧化物,它可以跟碱反应,二氧化硅能够与氢氟酸反应生成四氟化硅和水,故A错误;B.光导纤维的主要成分是晶体二氧化硅,故B错误;C.硅石、石英、水晶、玛瑙中均含有二氧化硅,故C正确;D.明矾净水是因为Al3+水解生成Al(OH)3胶体,胶体有吸附性能,可净水,但其没有强氧化性,不能杀菌消毒,故D错误;答案为C。18、①向饱和碳酸钠溶液中通入过量的CO2,碳酸钠和二氧化碳、水反应生成碳酸氢钠,反应为Na2CO3+CO2+H2O=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,原碳酸钠溶液是饱和溶液,生成碳酸氢钠后溶液变成过饱和溶液,所以会析出部分碳酸氢钠晶体,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故①错误;②向Fe(OH)3胶体中加入H2SO4会出现先凝聚生成Fe(OH)3沉淀,H2SO4过量,Fe(OH)3与H2SO4反应生成易溶于水的硫酸铁和水而溶解,出现“先产生沉淀,然后沉淀又溶解”现象,故②正确;③弱酸不能制强酸,向BaCl2溶液中通入CO2 始终无沉淀生成,故③错误;④石灰水和CO2反应,生成CaCO3沉淀,继续通入CO2,会与CaCO3反应生成可溶的Ca(HCO3)2,沉淀又溶解,所以出现先沉淀后溶解现象,故④正确;⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量,始终生成BaSO4沉淀,生成的Al(OH)3最终会溶解于过量的Ba(OH)2,故⑤错误;⑥向NaAlO2溶液中滴入过量的盐酸,发生的反应方程式为:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,所以发生“先沉淀后溶解”现象,故⑥正确;答案为D。19、A.Na2O和Na2O2均能与H2O反应生成NaOH,Na2O2和水反应生成氢氧化钠和氧气,Na2O是碱性氧化物,Na2O2不是碱性氧化物,故A错误;B.分散系本质特征是分散质微粒直径大小,分散质微粒直径小于1nm形成的分散系为溶液,1nm-100nm形成的为胶体,大于100nm形成的分散系为浊液,丁达尔现象是胶体的特征性质,故B错误;C.电解质和非电解质概念分析可知非电解质本身不能电离出自由移动的离子,电解质能电离出自由移动的离子,如BaSO4水溶液不导电,但熔融状态导电属于电解质,故C错误;D.碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故D正确;故选D。20、(1)过氧化钠与CO2反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2; (2)镁条在二氧化碳中燃烧生成氧化镁和碳的化学方程式为2Mg+CO22MgO+C; (3)将少量硫酸铝溶液滴入足量NaOH溶液生成NaAlO2,发生反应的离子方程式为Al3++4OH- = AlO2-+2H2O ; (4)铁与高温水蒸气反应生成四氧化三铁和氢气,发生反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。21、(1)由实验过程及结论可知,实验1的实验目的是验证Fe2+具有还原性,在FeCl2溶液中滴入适量氯水,根据实验现象可知,氯化亚铁能被氯气氧化,生成铁离子和氯离子,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;实验2的实验目的是验证Fe2+具有氧化性,能被锌置换出来,生成铁单质和锌离子,所以实验结论是证明Fe2+具有氧化性;实验3的实验目的是FeCl3(Fe3+)具有氧化性,铁离子与铁单质反应生成亚铁离子,实验现象为溶液由黄色变为浅绿色;综合以上实验,得到的结论是Fe3+有氧化性;Fe2+既有氧化性,又有还原性; (2)亚铁盐在溶液中加入少量的铁粉可以防止亚铁离子被氧化; (3)检验某溶液是Fe2+溶液的方法可以用K3[Fe(CN)6]溶液,看能否产生蓝色沉淀,也可以用KSCN溶液及氯水,KSCN溶液与亚铁离子没有明显现象,而遇铁离子能显血红色,所以检验的方法为加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀; (4)某同学向FeCl2中加入Na2O2,考虑到2H2O+Na2O2=4NaOH+O2↑,过氧化钠有强氧化性,能氧化亚铁离子生成铁离子,铁离子可以与NaOH溶液作用转化成氢氧化铁,氢氧化铁沉淀为红褐色。22、试题分析:(1)由图可知:加入20mL氢氧化钠溶液才开始产生沉淀,说明酸过量,先发生了酸碱中和反应,氢氧化钠溶液为160mL时,沉淀量最大,为Mg(OH)2和Al(OH)3,此过程消耗氢氧化钠的物质的量是(0.16-0.02)×5=0.7mol,之后沉淀溶解,溶解的沉淀是Al(OH)3,消耗氢氧化钠20mL, 发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18-0.16)×5=0.1mol,则可知铝离子生成沉淀消耗氢氧化钠0.3mol,所以镁离子生成沉淀消耗氢氧化钠是0.4mol,说明镁离子0.2mol,合金中镁的质量为0.2×24=4.8g (2)当氢氧化钠溶液为160mL时,沉淀量最大,此时溶液完全为氯化钠溶液,根据钠元素守恒, n(NaCl)=n(NaOH)=0.16×5=0.8mol,再根据氯元素守恒,n(HCl)=n(NaCl)=0.8mol,所以盐酸的物质的量浓度为0.8/0.1="8" mol/L 考点:镁铝的性质及图像分析23、(1)①加入氢氧化钠溶液的目的是为了除去Mg2+;除去SO42-用BaCl2溶液,除去Ca2+和过量的Ba2+用Na2CO3溶液,故可知步骤b中应加入BaCl2溶液或Ba(OH)2溶液,步骤c应加入过量的Na2CO3溶液; ②步骤c是加入过量的Na2CO3溶液以除去Ca2+和过量的Ba2+,故离子方程式为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓; (3)NaHCO3固体加热即可分解为CO2和Na2CO3和水,方程式为:2NaHCO3Na2CO3+CO2↑+H2O; (4)二氧化碳的物质的量n==0.05mol,而1molNa2CO3~1molCO2,故Na2CO3的物质的量为0.05mol,则Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g,故纯碱的质量分数=×100%=96.4%。 点睛:除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所引入的过量试剂;本题根据硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析。A.①③④ B.①②⑥ C.①③⑤ D.①③⑥
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵
16、A.Fe3+与SCN-在同一溶液中生成红色溶液,不能大量共存,故A错误;B.Na+、K+、AlO2-、CO32-彼此间不发生离子反应,可大量共存于碱性溶液中,故B正确;C.在能使酚酞试剂变红的溶液显碱性,NH4+、Al3+均不能在碱性溶液中大量存在,故C错误;D.Fe2+在酸性条件下能被NO3-氧化,故D错误;答案为B。 点睛:离子反应发生的条件,主要是离子间不能结合生成水、气体、沉淀,不能发生氧化还原反应等,通常可熟记常见的易错的一些离子反应,如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存等;易错选项A中忽视溶液中已经存在的Fe3+与SCN-之间的配合反应。
17、A.二氧化硅是酸性氧化物,它可以跟碱反应,二氧化硅能够与氢氟酸反应生成四氟化硅和水,故A错误;B.光导纤维的主要成分是晶体二氧化硅,故B错误;C.硅石、石英、水晶、玛瑙中均含有二氧化硅,故C正确;D.明矾净水是因为Al3+水解生成Al(OH)3胶体,胶体有吸附性能,可净水,但其没有强氧化性,不能杀菌消毒,故D错误;答案为C。
18、①向饱和碳酸钠溶液中通入过量的CO2,碳酸钠和二氧化碳、水反应生成碳酸氢钠,反应为Na2CO3+CO2+H2O=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,原碳酸钠溶液是饱和溶液,生成碳酸氢钠后溶液变成过饱和溶液,所以会析出部分碳酸氢钠晶体,所以不出现“先产生沉淀,然后沉淀又溶解”现象,故①错误;②向Fe(OH)3胶体中加入H2SO4会出现先凝聚生成Fe(OH)3沉淀,H2SO4过量,Fe(OH)3与H2SO4反应生成易溶于水的硫酸铁和水而溶解,出现“先产生沉淀,然后沉淀又溶解”现象,故②正确;③弱酸不能制强酸,向BaCl2溶液中通入CO2 始终无沉淀生成,故③错误;④石灰水和CO2反应,生成CaCO3沉淀,继续通入CO2,会与CaCO3反应生成可溶的Ca(HCO3)2,沉淀又溶解,所以出现先沉淀后溶解现象,故④正确;⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量,始终生成BaSO4沉淀,生成的Al(OH)3最终会溶解于过量的Ba(OH)2,故⑤错误;⑥向NaAlO2溶液中滴入过量的盐酸,发生的反应方程式为:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,所以发生“先沉淀后溶解”现象,故⑥正确;答案为D。
19、A.Na2O和Na2O2均能与H2O反应生成NaOH,Na2O2和水反应生成氢氧化钠和氧气,Na2O是碱性氧化物,Na2O2不是碱性氧化物,故A错误;B.分散系本质特征是分散质微粒直径大小,分散质微粒直径小于1nm形成的分散系为溶液,1nm-100nm形成的为胶体,大于100nm形成的分散系为浊液,丁达尔现象是胶体的特征性质,故B错误;C.电解质和非电解质概念分析可知非电解质本身不能电离出自由移动的离子,电解质能电离出自由移动的离子,如BaSO4水溶液不导电,但熔融状态导电属于电解质,故C错误;D.碱性氧化物一定是金属氧化物,酸性氧化物可以是金属氧化物,如:Mn2O7是酸性氧化物,故D正确;故选D。
20、(1)过氧化钠与CO2反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2; (2)镁条在二氧化碳中燃烧生成氧化镁和碳的化学方程式为2Mg+CO2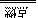 2MgO+C; (3)将少量硫酸铝溶液滴入足量NaOH溶液生成NaAlO2,发生反应的离子方程式为Al3++4OH- = AlO2-+2H2O ; (4)铁与高温水蒸气反应生成四氧化三铁和氢气,发生反应的化学方程式为3Fe+4H2O(g)
2MgO+C; (3)将少量硫酸铝溶液滴入足量NaOH溶液生成NaAlO2,发生反应的离子方程式为Al3++4OH- = AlO2-+2H2O ; (4)铁与高温水蒸气反应生成四氧化三铁和氢气,发生反应的化学方程式为3Fe+4H2O(g)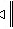 Fe3O4+4H2。
Fe3O4+4H2。
21、(1)由实验过程及结论可知,实验1的实验目的是验证Fe2+具有还原性,在FeCl2溶液中滴入适量氯水,根据实验现象可知,氯化亚铁能被氯气氧化,生成铁离子和氯离子,反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;实验2的实验目的是验证Fe2+具有氧化性,能被锌置换出来,生成铁单质和锌离子,所以实验结论是证明Fe2+具有氧化性;实验3的实验目的是FeCl3(Fe3+)具有氧化性,铁离子与铁单质反应生成亚铁离子,实验现象为溶液由黄色变为浅绿色;综合以上实验,得到的结论是Fe3+有氧化性;Fe2+既有氧化性,又有还原性; (2)亚铁盐在溶液中加入少量的铁粉可以防止亚铁离子被氧化; (3)检验某溶液是Fe2+溶液的方法可以用K3[Fe(CN)6]溶液,看能否产生蓝色沉淀,也可以用KSCN溶液及氯水,KSCN溶液与亚铁离子没有明显现象,而遇铁离子能显血红色,所以检验的方法为加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀; (4)某同学向FeCl2中加入Na2O2,考虑到2H2O+Na2O2=4NaOH+O2↑,过氧化钠有强氧化性,能氧化亚铁离子生成铁离子,铁离子可以与NaOH溶液作用转化成氢氧化铁,氢氧化铁沉淀为红褐色。
22、试题分析:(1)由图可知:加入20mL氢氧化钠溶液才开始产生沉淀,说明酸过量,先发生了酸碱中和反应,氢氧化钠溶液为160mL时,沉淀量最大,为Mg(OH)2和Al(OH)3,此过程消耗氢氧化钠的物质的量是(0.16-0.02)×5=0.7mol,之后沉淀溶解,溶解的沉淀是Al(OH)3,消耗氢氧化钠20mL, 发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18-0.16)×5=0.1mol,则可知铝离子生成沉淀消耗氢氧化钠0.3mol,所以镁离子生成沉淀消耗氢氧化钠是0.4mol,说明镁离子0.2mol,合金中镁的质量为0.2×24=4.8g (2)当氢氧化钠溶液为160mL时,沉淀量最大,此时溶液完全为氯化钠溶液,根据钠元素守恒, n(NaCl)=n(NaOH)=0.16×5=0.8mol,再根据氯元素守恒,n(HCl)=n(NaCl)=0.8mol,所以盐酸的物质的量浓度为0.8/0.1="8" mol/L 考点:镁铝的性质及图像分析
23、(1)①加入氢氧化钠溶液的目的是为了除去Mg2+;除去SO42-用BaCl2溶液,除去Ca2+和过量的Ba2+用Na2CO3溶液,故可知步骤b中应加入BaCl2溶液或Ba(OH)2溶液,步骤c应加入过量的Na2CO3溶液; ②步骤c是加入过量的Na2CO3溶液以除去Ca2+和过量的Ba2+,故离子方程式为Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓; (3)NaHCO3固体加热即可分解为CO2和Na2CO3和水,方程式为:2NaHCO3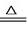 Na2CO3+CO2↑+H2O; (4)二氧化碳的物质的量n=
Na2CO3+CO2↑+H2O; (4)二氧化碳的物质的量n=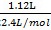 =0.05mol,而1molNa2CO3~1molCO2,故Na2CO3的物质的量为0.05mol,则Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g,故纯碱的质量分数=
=0.05mol,而1molNa2CO3~1molCO2,故Na2CO3的物质的量为0.05mol,则Na2CO3的质量m=nM=0.05mol×106g/mol=5.3g,故纯碱的质量分数=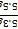 ×100%=96.4%。 点睛:除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所引入的过量试剂;本题根据硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析。
×100%=96.4%。 点睛:除去多种杂质时,要考虑加入试剂的顺序,为了保证将杂质除尽,所加试剂必须过量,因此为了不引进新的杂质,后面加入的试剂要能够除去前面所引入的过量试剂;本题根据硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析。
A.①③④ B.①②⑥ C.①③⑤ D.①③⑥
题目解答
答案
C