题目
以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如图:H2SO4-|||-足量 (NH4)2SO4-|||-H2SO4 黄铁矿 H2O NaClO3-|||-K3[Fe(CN)6] H2SO4-|||-(50%)-|||-加热| 加热 加热-|||-工 .=3 加热-|||-查一 酸浸 质 序 一 溶 一 沉铁 氧化 洗涤、 铵-|||-① 液 干燥 蓝-|||-滤渣① 滤渣②-|||-母液回答下列问题:(1)红渣的主要成分为 ____ (填化学式),滤渣①的主要成分为 ____ (填化学式)。(2)黄铁矿研细的目的是 ____ 。(3)还原工序中,不生成S单质的反应的化学方程式为 ____ 。(4)工序①的名称为 ____ ,所得母液循环使用。(5)沉铁工序产生的白色沉淀Fe(NH4)Fe(CN)6中Fe的化合价为 ____ ,氧化工序发生反应的离子方程式为 ____ 。(6)若用还原工序得到的滤液制备Fe2O3•xH2O和(NH4)2SO4,所加试剂为 ____ 和 ____ (填化学式,不引入杂质)。
以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如图:
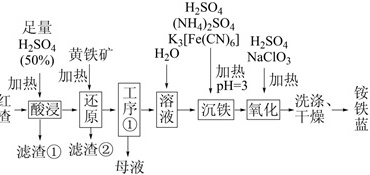
回答下列问题:
(1)红渣的主要成分为 ____ (填化学式),滤渣①的主要成分为 ____ (填化学式)。
(2)黄铁矿研细的目的是 ____ 。
(3)还原工序中,不生成S单质的反应的化学方程式为 ____ 。
(4)工序①的名称为 ____ ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)Fe(CN)6中Fe的化合价为 ____ ,氧化工序发生反应的离子方程式为 ____ 。
(6)若用还原工序得到的滤液制备Fe2O3•xH2O和(NH4)2SO4,所加试剂为 ____ 和 ____ (填化学式,不引入杂质)。

回答下列问题:
(1)红渣的主要成分为 ____ (填化学式),滤渣①的主要成分为 ____ (填化学式)。
(2)黄铁矿研细的目的是 ____ 。
(3)还原工序中,不生成S单质的反应的化学方程式为 ____ 。
(4)工序①的名称为 ____ ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀Fe(NH4)Fe(CN)6中Fe的化合价为 ____ ,氧化工序发生反应的离子方程式为 ____ 。
(6)若用还原工序得到的滤液制备Fe2O3•xH2O和(NH4)2SO4,所加试剂为 ____ 和 ____ (填化学式,不引入杂质)。
题目解答
答案
解:(1)由分析可知,红渣的主要成分为:Fe2O3,滤渣①的主要成分为:SiO2,
故答案为:Fe2O3;SiO2;
(2)黄铁矿研细的主要目的是增大固液接触面积,加快反应速率,提高黄铁矿的利用率,
故答案为:增大固液接触面积,加快反应速率,提高黄铁矿的利用率;
(3)由分析可知,还原工序中,不产生S单质沉淀,则硫元素被氧化为SO42-,反应原理为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+,故化学方程式为:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4,
故答案为:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4;
(4)由分析可知,工序①的名称为蒸发浓缩、冷却结晶、过滤洗涤,所得母液主要含有FeSO4溶液和H2SO4可以循环利用,
故答案为:蒸发浓缩、冷却结晶、过滤洗涤;
(5)沉铁工序中产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为+2价和[Fe(CN)6]3-中的+3价,由分析可知,氧化工序所发生的离子方程式为:Fe(NH4)2Fe(CN)6+ClO-+2H+=Fe(NH4)Fe(CN)6+H2O+Cl-+NH4+,
故答案为:+2、+3;Fe(NH4)2Fe(CN)6+ClO-+2H+=Fe(NH4)Fe(CN)6+H2O+Cl-+NH4+;
(6)由分析可知,还原工序所得的滤液中主要含有FeSO4溶液和H2SO4,向滤液中先加入一定量的H2O2溶液将Fe2+完全氧化为Fe3+,在向氧化后的溶液中加入氨水至不再产生沉淀为止,过滤洗涤,对沉淀进行灼烧,即可制得Fe2O3•x H2O和(NH4)2SO4,故所需要加入的试剂为H2O2和NH3•H2O,
故答案为:H2O2;NH3•H2O。
故答案为:Fe2O3;SiO2;
(2)黄铁矿研细的主要目的是增大固液接触面积,加快反应速率,提高黄铁矿的利用率,
故答案为:增大固液接触面积,加快反应速率,提高黄铁矿的利用率;
(3)由分析可知,还原工序中,不产生S单质沉淀,则硫元素被氧化为SO42-,反应原理为:14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+,故化学方程式为:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4,
故答案为:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4;
(4)由分析可知,工序①的名称为蒸发浓缩、冷却结晶、过滤洗涤,所得母液主要含有FeSO4溶液和H2SO4可以循环利用,
故答案为:蒸发浓缩、冷却结晶、过滤洗涤;
(5)沉铁工序中产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为+2价和[Fe(CN)6]3-中的+3价,由分析可知,氧化工序所发生的离子方程式为:Fe(NH4)2Fe(CN)6+ClO-+2H+=Fe(NH4)Fe(CN)6+H2O+Cl-+NH4+,
故答案为:+2、+3;Fe(NH4)2Fe(CN)6+ClO-+2H+=Fe(NH4)Fe(CN)6+H2O+Cl-+NH4+;
(6)由分析可知,还原工序所得的滤液中主要含有FeSO4溶液和H2SO4,向滤液中先加入一定量的H2O2溶液将Fe2+完全氧化为Fe3+,在向氧化后的溶液中加入氨水至不再产生沉淀为止,过滤洗涤,对沉淀进行灼烧,即可制得Fe2O3•x H2O和(NH4)2SO4,故所需要加入的试剂为H2O2和NH3•H2O,
故答案为:H2O2;NH3•H2O。