题目
(1)分析以下四个反应(未配平),填空:A.N(a)_(2)(O)_(2)+HClto (H)_(2)(O)_(2)+NaClB.A(g)_(2)O+(H)_(2)(O)_(2)to Ag+(O)_(2)+(H)_(2)OC.(H)_(2)(O)_(2)to (H)_(2)O+(O)_(2)D.(H)_(2)(O)_(2)+C(r)_(2)(S(O)_(4)())_(3)+KOHto (K)_(2)Cr(O)_(4)+(K)_(2)S(O)_(4)+(H)_(2)O①(H)_(2)(O)_(2)仅体现氧化性的是 ;(H)_(2)(O)_(2)仅体现还原性的是 ;(H)_(2)(O)_(2)既体现氧化性又体现还原性的是 ;(H)_(2)(O)_(2)既不能体现氧化性又不能体现还原性的是 (填代号).②D反应中1分子氧化剂完全反应转移电子为 个.(2)Cl(O)_(2)是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaCl(O)_(2)+4HCl=!=!=5NaCl+4Cl(O)_(2)uparrow +2(H)_(2)O。该反应中氧化剂是 ,请用双线桥标明电子转移的方向。
(1)分析以下四个反应(未配平),填空:
A.$N{a}_{2}{O}_{2}+HCl\to {H}_{2}{O}_{2}+NaCl$
B.$A{g}_{2}O+{H}_{2}{O}_{2}\to Ag+{O}_{2}+{H}_{2}O$
C.${H}_{2}{O}_{2}\to {H}_{2}O+{O}_{2}$
D.${H}_{2}{O}_{2}+C{r}_{2}(S{O}_{4}{)}_{3}+KOH\to {K}_{2}Cr{O}_{4}+{K}_{2}S{O}_{4}+{H}_{2}O$
①${H}_{2}{O}_{2}$仅体现氧化性的是 ;${H}_{2}{O}_{2}$仅体现还原性的是 ;${H}_{2}{O}_{2}$既体现氧化性又体现还原性的是 ;${H}_{2}{O}_{2}$既不能体现氧化性又不能体现还原性的是 (填代号).
②D反应中1分子氧化剂完全反应转移电子为 个.
(2)$Cl{O}_{2}$是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:$5NaCl{O}_{2}+4HCl=\!=\!=5NaCl+4Cl{O}_{2}\uparrow +2{H}_{2}O$。该反应中氧化剂是 ,请用双线桥标明电子转移的方向。
题目解答
答案
(1)①D;B;C;A;②2;
(2)${\mathrm{NaClO}}_{2}$;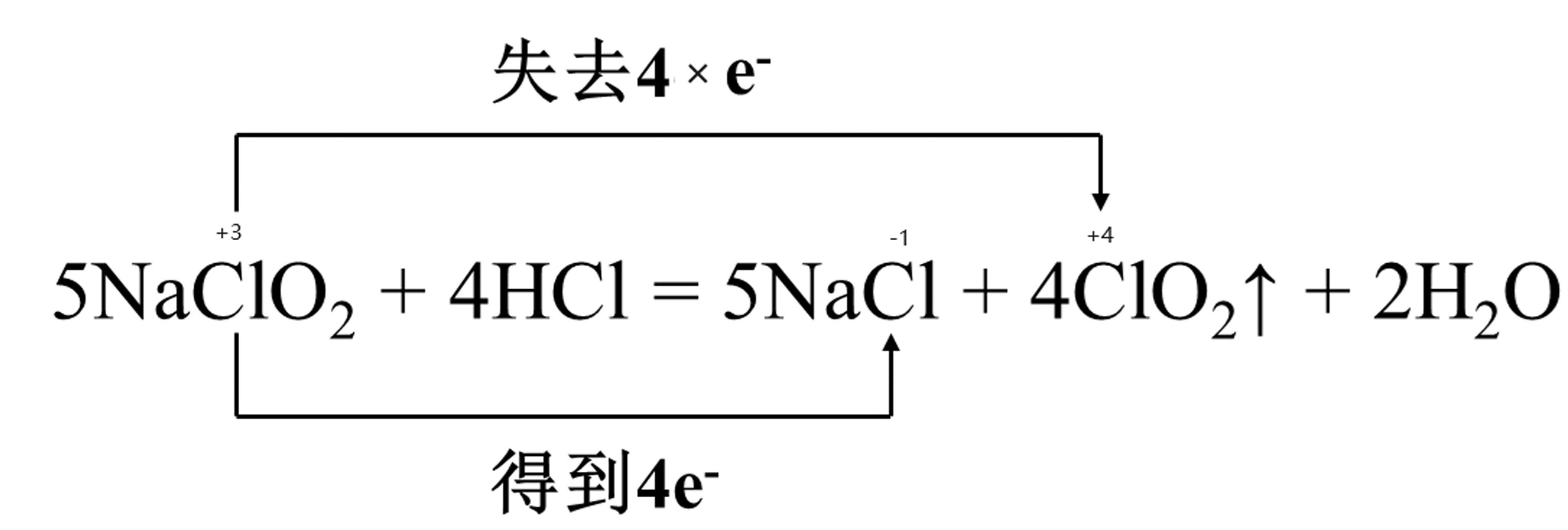 。
。
解析
步骤 1:分析反应中${H}_{2}{O}_{2}$的氧化性和还原性
在反应A中,${H}_{2}{O}_{2}$的氧元素的化合价没有变化,因此${H}_{2}{O}_{2}$既不能体现氧化性又不能体现还原性。
在反应B中,${H}_{2}{O}_{2}$的氧元素的化合价升高,因此${H}_{2}{O}_{2}$仅体现还原性。
在反应C中,${H}_{2}{O}_{2}$的氧元素的化合价既升高又降低,因此${H}_{2}{O}_{2}$既体现氧化性又体现还原性。
在反应D中,${H}_{2}{O}_{2}$的氧元素的化合价降低,因此${H}_{2}{O}_{2}$仅体现氧化性。
步骤 2:计算D反应中1分子氧化剂完全反应转移电子数
在反应D中,${H}_{2}{O}_{2}$的氧元素的化合价从-1价降低到-2价,因此1分子${H}_{2}{O}_{2}$完全反应转移电子数为2个。
步骤 3:分析反应中氧化剂
在反应$5NaCl{O}_{2}+4HCl=\!=\!=5NaCl+4Cl{O}_{2}\uparrow +2{H}_{2}O$中,${\mathrm{NaClO}}_{2}$中的氯元素的化合价从+3价升高到+4价,因此${\mathrm{NaClO}}_{2}$是氧化剂。
步骤 4:用双线桥标明电子转移的方向
在反应$5NaCl{O}_{2}+4HCl=\!=\!=5NaCl+4Cl{O}_{2}\uparrow +2{H}_{2}O$中,${\mathrm{NaClO}}_{2}$中的氯元素的化合价从+3价升高到+4价,因此${\mathrm{NaClO}}_{2}$是氧化剂,失去$4\times {e}^{-}$,$HCl$中的氯元素的化合价从-1价降低到-2价,因此$HCl$是还原剂,得到$4{e}^{-}$。
在反应A中,${H}_{2}{O}_{2}$的氧元素的化合价没有变化,因此${H}_{2}{O}_{2}$既不能体现氧化性又不能体现还原性。
在反应B中,${H}_{2}{O}_{2}$的氧元素的化合价升高,因此${H}_{2}{O}_{2}$仅体现还原性。
在反应C中,${H}_{2}{O}_{2}$的氧元素的化合价既升高又降低,因此${H}_{2}{O}_{2}$既体现氧化性又体现还原性。
在反应D中,${H}_{2}{O}_{2}$的氧元素的化合价降低,因此${H}_{2}{O}_{2}$仅体现氧化性。
步骤 2:计算D反应中1分子氧化剂完全反应转移电子数
在反应D中,${H}_{2}{O}_{2}$的氧元素的化合价从-1价降低到-2价,因此1分子${H}_{2}{O}_{2}$完全反应转移电子数为2个。
步骤 3:分析反应中氧化剂
在反应$5NaCl{O}_{2}+4HCl=\!=\!=5NaCl+4Cl{O}_{2}\uparrow +2{H}_{2}O$中,${\mathrm{NaClO}}_{2}$中的氯元素的化合价从+3价升高到+4价,因此${\mathrm{NaClO}}_{2}$是氧化剂。
步骤 4:用双线桥标明电子转移的方向
在反应$5NaCl{O}_{2}+4HCl=\!=\!=5NaCl+4Cl{O}_{2}\uparrow +2{H}_{2}O$中,${\mathrm{NaClO}}_{2}$中的氯元素的化合价从+3价升高到+4价,因此${\mathrm{NaClO}}_{2}$是氧化剂,失去$4\times {e}^{-}$,$HCl$中的氯元素的化合价从-1价降低到-2价,因此$HCl$是还原剂,得到$4{e}^{-}$。