5.已知25℃时,苯蒸气和液态苯的标准摩尔生成焓 (Delta )_({t)^1}_(m) 分别为 .93kJcdot mo(l)^-1 和 .66kJcdot mo(l)^-1 在-|||-101325Pa下苯的沸点是80.1℃。若25℃时甲烷溶在苯中,平衡组成 (C(H)_(4))=0.0043 时,与其平衡的气相-|||-中CH4的分压力为245kPa。试计算:-|||-(1)25℃时,当 (C(H)_(4))=0.01 时的甲烷苯溶液的蒸气总压力p;-|||-(2)与上述溶液成平衡的气相组成y(CH4)。

题目解答
答案
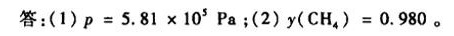
解析
本题考查溶液蒸气压及气相组成的计算,涉及克劳修斯-克拉佩龙方程、亨利定律和道尔顿分压定律的应用。解题关键点如下:
- 计算纯苯在25℃时的蒸气压:利用克劳修斯-克拉佩龙方程,结合苯的沸点和汽化焓。
- 确定亨利常数:根据题目给出的平衡组成与分压,求出甲烷在苯中的亨利常数。
- 总蒸气压计算:将苯的蒸气压(拉乌尔定律)与甲烷的分压(亨利定律)相加。
- 气相组成计算:通过分压与总压的比值确定气相中甲烷的摩尔分数。
第(1)题:计算蒸气总压力$p$
计算纯苯在25℃时的蒸气压$P_{\text{benzene}}^0$
根据克劳修斯-克拉佩龙方程:
$\ln\frac{P_2}{P_1} = -\frac{\Delta H_{\text{vap}}}{R}\left(\frac{1}{T_2} - \frac{1}{T_1}\right)$
其中:
- $P_1 = 101325 \, \text{Pa}$(沸点80.1℃时的蒸气压),
- $T_1 = 353.3 \, \text{K}$,$T_2 = 298.15 \, \text{K}$,
- $\Delta H_{\text{vap}} = 82.93 - 48.66 = 34.27 \, \text{kJ/mol}$,
- $R = 8.314 \, \text{J/mol·K}$。
代入计算得:
$\ln\frac{P_2}{101325} = -\frac{34270}{8.314} \left(\frac{1}{298.15} - \frac{1}{353.3}\right) \approx -2.163$
解得:
$P_2 \approx 101325 \cdot e^{-2.163} \approx 11768 \, \text{Pa}$
计算甲烷的分压
根据亨利定律,当$x_{\text{CH}_4} = 0.0043$时,分压$p_{\text{CH}_4} = 245 \, \text{kPa}$,可得亨利常数:
$k = \frac{p}{x} = \frac{245000}{0.0043} \approx 57 \times 10^6 \, \text{Pa·mol}^{-1}$
当$x_{\text{CH}_4} = 0.01$时,甲烷的分压为:
$p_{\text{CH}_4} = k \cdot x = 57 \times 10^6 \cdot 0.01 = 570000 \, \text{Pa}$
计算总蒸气压
苯的蒸气压为:
$p_{\text{benzene}} = x_{\text{benzene}} \cdot P_{\text{benzene}}^0 = (1 - 0.01) \cdot 11768 \approx 11650 \, \text{Pa}$
总蒸气压:
$p = p_{\text{benzene}} + p_{\text{CH}_4} = 11650 + 570000 = 581650 \, \text{Pa}$
第(2)题:计算气相组成$y_{\text{CH}_4}$
根据道尔顿分压定律,气相中甲烷的分压占总压的比例为:
$y_{\text{CH}_4} = \frac{p_{\text{CH}_4}}{p} = \frac{570000}{581650} \approx 0.980$