题目
(1)欲增加CaCO3在水中的溶解度,可以采取的措施是 ()-|||-A.加入HCl溶液 B.加入Na2CO3溶液-|||-C.加入CaCl2溶液 D.加入NaCl溶液-|||-E.减小溶液的pH值

题目解答
答案
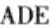
解析
本题考查难溶盐CaCO3的溶解度影响因素,核心思路是运用溶度积原理和勒沙特列原理分析各措施对溶解平衡的影响。关键点在于:
- 酸的作用:H+与CO3^2-反应,降低产物浓度,促进溶解。
- 同离子效应:加入含有相同离子的物质会抑制溶解。
- 稀释效应:加入无关盐稀释溶液,降低离子浓度,可能促进溶解。
选项分析
A. 加入HCl溶液
HCl中的H+与CO3^2-反应:
$2H^+ + CO_3^{2-} \rightarrow CO_2\uparrow + H_2O$
减少CO3^2-浓度,平衡右移,溶解度增大。正确。
B. 加入Na2CO3溶液
Na2CO3解离出大量CO3^2-,增大产物浓度,平衡左移,溶解度减小。错误。
C. 加入CaCl2溶液
CaCl2解离出Ca²+,增大反应物浓度,平衡左移,溶解度减小。错误。
D. 加入NaCl溶液
NaCl解离出Na+和Cl-,与CaCO3的离子无关。稀释效应降低Ca²+和CO3^2-浓度,平衡右移,溶解度增大。正确。
E. 减小溶液的pH值
pH减小即H+浓度增大,与选项A类似,减少CO3^2-浓度,促进溶解。正确。