题目
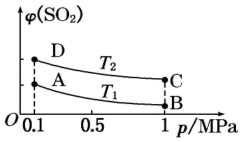
φ(SO2)-|||-D-|||-T2-|||-A-|||-T B-|||-0.0.1 0.5 1p /MPa在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1.经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是 ____ 。(填字母)a.SO2、O2、SO3三者的浓度之比为2:1:2b.容器内气体的压强不变c.容器内混合气体的密度保持不变d.SO3的物质的量不再变化e.SO2的生成速率和SO3的生成速率相等(2)从反应开始到平衡的这段时间用SO2的浓度变化表示的平均反应速率v(SO2)= ____ ,其平衡常数表达式为K= ____ 。(3)SO2的转化率为 ____ ,达到平衡时反应放出的热量为 ____ 。(4)若反应温度升高,SO2的转化率 ____ 。(填“增大”、“减小”或“不变”)(5)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1 ____ T2.(填“>”、“<”或“=”)
 在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1.经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
在一定温度下,向一容积为5L的恒容密闭容器中充入0.4mol SO2和0.2mol O2,发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H=-196kJ•mol-1.经2min后达到平衡,当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:(1)判断该反应达到平衡状态的标志是 ____ 。(填字母)
a.SO2、O2、SO3三者的浓度之比为2:1:2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)从反应开始到平衡的这段时间用SO2的浓度变化表示的平均反应速率v(SO2)= ____ ,其平衡常数表达式为K= ____ 。
(3)SO2的转化率为 ____ ,达到平衡时反应放出的热量为 ____ 。
(4)若反应温度升高,SO2的转化率 ____ 。(填“增大”、“减小”或“不变”)
(5)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。则温度关系:T1 ____ T2.(填“>”、“<”或“=”)
题目解答
答案
解:(1)a.SO2、O2、SO3三者的浓度之比为2:1:2的状态也可能不符合Qc=K的结论,也可能符合,这不是平衡的标志,故a错误;
b.反应是一个前后气体系数变化的反应,容器内气体的压强不变,证明达到了平衡,故b正确;
c.容器内混合气体的密度始终保持不变,所以密度不变不一定平衡,故c错误;
d.SO3的物质的量不再变化即浓度不再变化是平衡的特征,故d正确;
e.SO2的生成速率和SO3的生成速率相等,说明正逆反应速率相等,达到了平衡,故e正确;
故答案为:bde;
(2)设SO2的变化浓度是x,则
2SO2(g)+O2(g)⇌2SO3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
则平均反应速率v(SO2)=$\frac{\frac{0.36mol}{5L}}{2min}$=0.036mol/(L•min);
平衡常数表达式K=$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$,
故答案为:0.036mol/(L•min);$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$;
(3)二氧化硫的转化率=$\frac{0.36mol}{0.4mol}$×100%=90%;2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196kJ/mol,反应过程中消耗二氧化硫物质的量2mol放热196kJ,上述计算二氧化硫消耗物质的量为0.36mol,放出热量=$\frac{0.36mol}{2mol}×196kJ$=35.28kJ,
故答案为:90%;35.28kJ;
(4)由于该反应是一个放热反应,升高温度时平衡向吸热反应方向移动,即逆反应方向,故升高温度SO2的物质的量增大,SO2的转化率减小,
故答案为:减小;
(5)压强相同时从T1到T2,SO2的体积分数不断增加,可以说明反应向逆向移动,故从T1到T2为升高温度的过程,T1<T2,
故答案为:<。
b.反应是一个前后气体系数变化的反应,容器内气体的压强不变,证明达到了平衡,故b正确;
c.容器内混合气体的密度始终保持不变,所以密度不变不一定平衡,故c错误;
d.SO3的物质的量不再变化即浓度不再变化是平衡的特征,故d正确;
e.SO2的生成速率和SO3的生成速率相等,说明正逆反应速率相等,达到了平衡,故e正确;
故答案为:bde;
(2)设SO2的变化浓度是x,则
2SO2(g)+O2(g)⇌2SO3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
则平均反应速率v(SO2)=$\frac{\frac{0.36mol}{5L}}{2min}$=0.036mol/(L•min);
平衡常数表达式K=$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$,
故答案为:0.036mol/(L•min);$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$;
(3)二氧化硫的转化率=$\frac{0.36mol}{0.4mol}$×100%=90%;2SO2(g)+O2 (g)⇌2SO3 (g)△H=-196kJ/mol,反应过程中消耗二氧化硫物质的量2mol放热196kJ,上述计算二氧化硫消耗物质的量为0.36mol,放出热量=$\frac{0.36mol}{2mol}×196kJ$=35.28kJ,
故答案为:90%;35.28kJ;
(4)由于该反应是一个放热反应,升高温度时平衡向吸热反应方向移动,即逆反应方向,故升高温度SO2的物质的量增大,SO2的转化率减小,
故答案为:减小;
(5)压强相同时从T1到T2,SO2的体积分数不断增加,可以说明反应向逆向移动,故从T1到T2为升高温度的过程,T1<T2,
故答案为:<。
解析
步骤 1:判断平衡状态的标志
a.SO_2、O_2、SO_3三者的浓度之比为2:1:2的状态不一定符合Qc=K的结论,故a错误;
b.反应是一个前后气体系数变化的反应,容器内气体的压强不变,证明达到了平衡,故b正确;
c.容器内混合气体的密度始终保持不变,所以密度不变不一定平衡,故c错误;
d.SO_3的物质的量不再变化即浓度不再变化是平衡的特征,故d正确;
e.SO_2的生成速率和SO_3的生成速率相等,说明正逆反应速率相等,达到了平衡,故e正确;
步骤 2:计算SO_2的平均反应速率和平衡常数表达式
设SO_2的变化浓度是x,则
2SO_2(g)+O_2(g)⇌2SO_3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
则平均反应速率v(SO_2)=$\frac{\frac{0.36mol}{5L}}{2min}$=0.036mol/(L•min);
平衡常数表达式K=$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$,
步骤 3:计算SO_2的转化率和反应放出的热量
二氧化硫的转化率=$\frac{0.36mol}{0.4mol}$×100%=90%;2SO_2(g)+O_2 (g)⇌2SO_3 (g)△H=-196kJ/mol,反应过程中消耗二氧化硫物质的量2mol放热196kJ,上述计算二氧化硫消耗物质的量为0.36mol,放出热量=$\frac{0.36mol}{2mol}×196kJ$=35.28kJ,
步骤 4:判断温度升高对SO_2转化率的影响
由于该反应是一个放热反应,升高温度时平衡向吸热反应方向移动,即逆反应方向,故升高温度SO_2的物质的量增大,SO_2的转化率减小,
步骤 5:判断温度关系
压强相同时从T_1到T_2,SO_2的体积分数不断增加,可以说明反应向逆向移动,故从T_1到T_2为升高温度的过程,T_1<T_2,
a.SO_2、O_2、SO_3三者的浓度之比为2:1:2的状态不一定符合Qc=K的结论,故a错误;
b.反应是一个前后气体系数变化的反应,容器内气体的压强不变,证明达到了平衡,故b正确;
c.容器内混合气体的密度始终保持不变,所以密度不变不一定平衡,故c错误;
d.SO_3的物质的量不再变化即浓度不再变化是平衡的特征,故d正确;
e.SO_2的生成速率和SO_3的生成速率相等,说明正逆反应速率相等,达到了平衡,故e正确;
步骤 2:计算SO_2的平均反应速率和平衡常数表达式
设SO_2的变化浓度是x,则
2SO_2(g)+O_2(g)⇌2SO_3(g)
初始物质的量:0.4 0.2 0
变化物质的量:x 0.5x x
平衡物质的量:0.4-x 0.2-0.5x x
当反应达到平衡时,容器内压强变为起始时的0.7倍,则$\frac{0.4-x+0.2-0.5x+x}{0.4+0.2}$=0.7,解得x=0.36mol,
则平均反应速率v(SO_2)=$\frac{\frac{0.36mol}{5L}}{2min}$=0.036mol/(L•min);
平衡常数表达式K=$\frac{{{c^2}(S{O_3})}}{{{c^2}(S{O_2})c({O_2})}}$,
步骤 3:计算SO_2的转化率和反应放出的热量
二氧化硫的转化率=$\frac{0.36mol}{0.4mol}$×100%=90%;2SO_2(g)+O_2 (g)⇌2SO_3 (g)△H=-196kJ/mol,反应过程中消耗二氧化硫物质的量2mol放热196kJ,上述计算二氧化硫消耗物质的量为0.36mol,放出热量=$\frac{0.36mol}{2mol}×196kJ$=35.28kJ,
步骤 4:判断温度升高对SO_2转化率的影响
由于该反应是一个放热反应,升高温度时平衡向吸热反应方向移动,即逆反应方向,故升高温度SO_2的物质的量增大,SO_2的转化率减小,
步骤 5:判断温度关系
压强相同时从T_1到T_2,SO_2的体积分数不断增加,可以说明反应向逆向移动,故从T_1到T_2为升高温度的过程,T_1<T_2,