题目
5.22在100℃下,下列反应的 ^theta =8.1times (10)^-9 (Delta )_(r)({S)_(m)}^theta =125.6Jcdot (mol)^-1cdot (K)^-1 。计算:-|||-(Cl)_(2)(g)=!=!= CO(g)+(Cl)_(2)(g)-|||-(1)100℃,总压为200 kPa时COCl22的解离度;-|||-(2)100℃下上述反应的 (Delta )_(1)(H)_(m)^theta ;-|||-(3)总压为200 kPa,COCl2解离度为0.1%时的温度。设 (Delta )_(1)(C)_(p)m=0

题目解答
答案
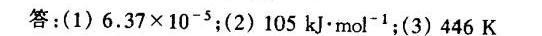
解析
步骤 1:计算100℃时COCl2的解离度
根据化学平衡原理,设COCl2的解离度为α,那么平衡时COCl2的分压为(1-α)P,CO和Cl2的分压均为αP。根据平衡常数K的定义,有:
\[ K = \frac{P_{CO} \cdot P_{Cl_2}}{P_{COCl_2}} = \frac{\alpha P \cdot \alpha P}{(1-\alpha)P} = \frac{\alpha^2 P}{(1-\alpha)P} = \frac{\alpha^2}{1-\alpha} \]
代入已知的K值和总压P,解方程求得α。
步骤 2:计算100℃下反应的焓变
根据热力学公式,焓变ΔH可以通过平衡常数K和熵变ΔS计算得到。使用公式:
\[ \Delta H = \Delta G + T \Delta S \]
其中,ΔG可以通过K值计算得到,ΔS已知,T为温度。
步骤 3:计算COCl2解离度为0.1%时的温度
根据步骤1中得到的解离度α和总压P,代入平衡常数K的表达式,解方程求得温度T。
根据化学平衡原理,设COCl2的解离度为α,那么平衡时COCl2的分压为(1-α)P,CO和Cl2的分压均为αP。根据平衡常数K的定义,有:
\[ K = \frac{P_{CO} \cdot P_{Cl_2}}{P_{COCl_2}} = \frac{\alpha P \cdot \alpha P}{(1-\alpha)P} = \frac{\alpha^2 P}{(1-\alpha)P} = \frac{\alpha^2}{1-\alpha} \]
代入已知的K值和总压P,解方程求得α。
步骤 2:计算100℃下反应的焓变
根据热力学公式,焓变ΔH可以通过平衡常数K和熵变ΔS计算得到。使用公式:
\[ \Delta H = \Delta G + T \Delta S \]
其中,ΔG可以通过K值计算得到,ΔS已知,T为温度。
步骤 3:计算COCl2解离度为0.1%时的温度
根据步骤1中得到的解离度α和总压P,代入平衡常数K的表达式,解方程求得温度T。