题目
400K时,在一恒容的抽空容器中,按化学计量比引入反应物A(g)和B(g),进行如下气相反应:(g)+2B(g)arrow 2(g)测得反应开始时,容器内总压为3.36kPa,反应进行1000s后总压降至2.12kPa。已知A(g)、B(g)的反应分级数分别为0.5和1.5,求速率常数(g)+2B(g)arrow 2(g)及半衰期t1/2。(10分)
400K时,在一恒容的抽空容器中,按化学计量比引入反应物A(g)和B(g),进行如下气相反应:
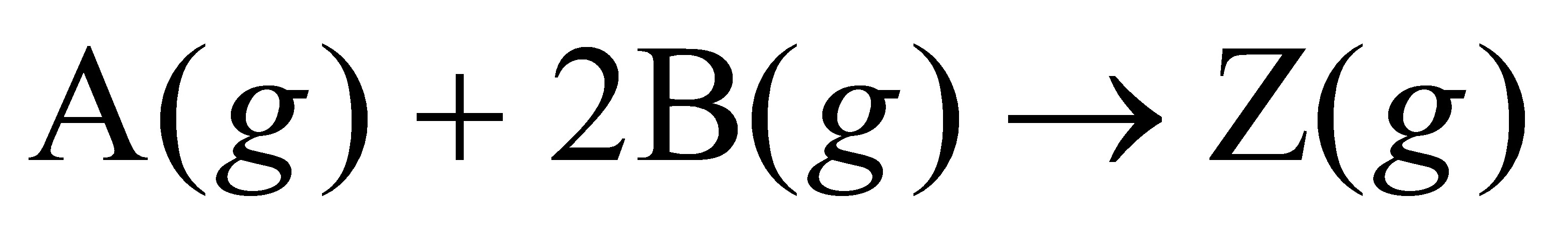
测得反应开始时,容器内总压为3.36kPa,反应进行1000s后总压降至2.12kPa。已知A(g)、B(g)的反应分级数分别为0.5和1.5,求速率常数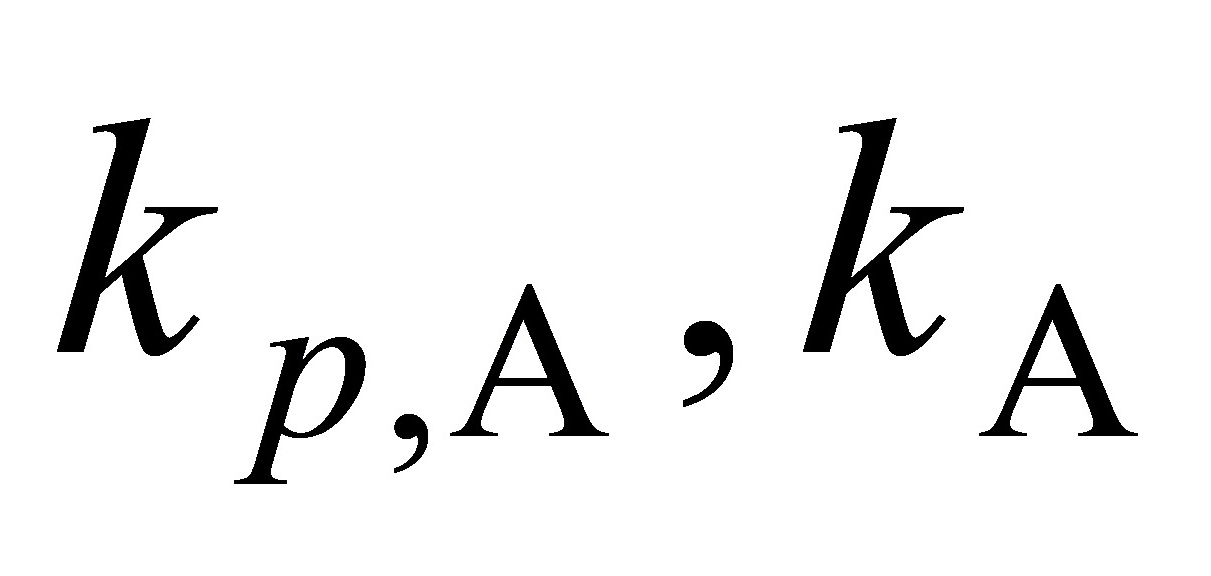 及半衰期t1/2。(10分)
及半衰期t1/2。(10分)
题目解答
答案
解(10分):以反应物A表示的速率方程为
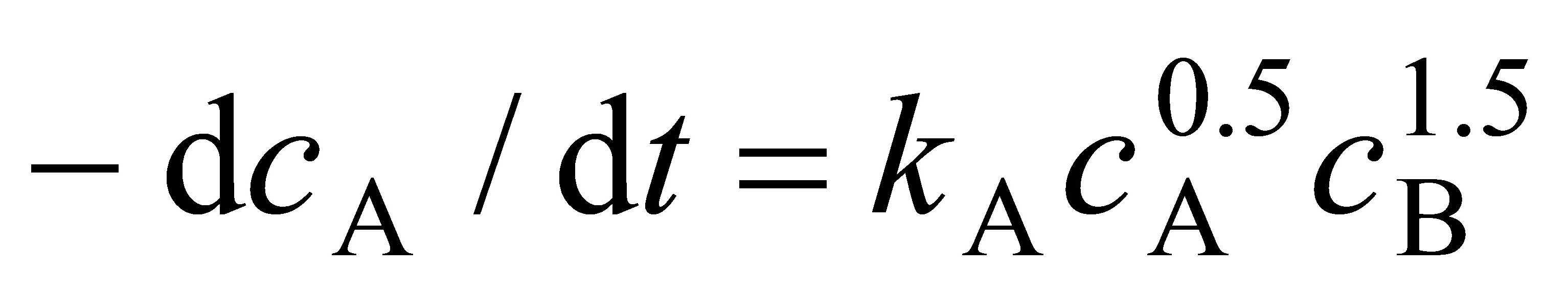
现实验测量的是压力,基于分压的A的速率方程为
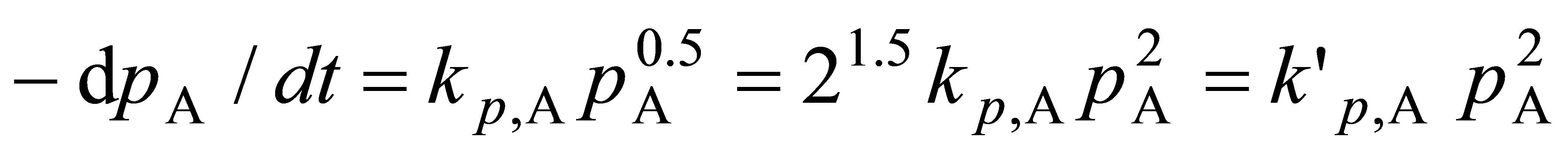
积分式为 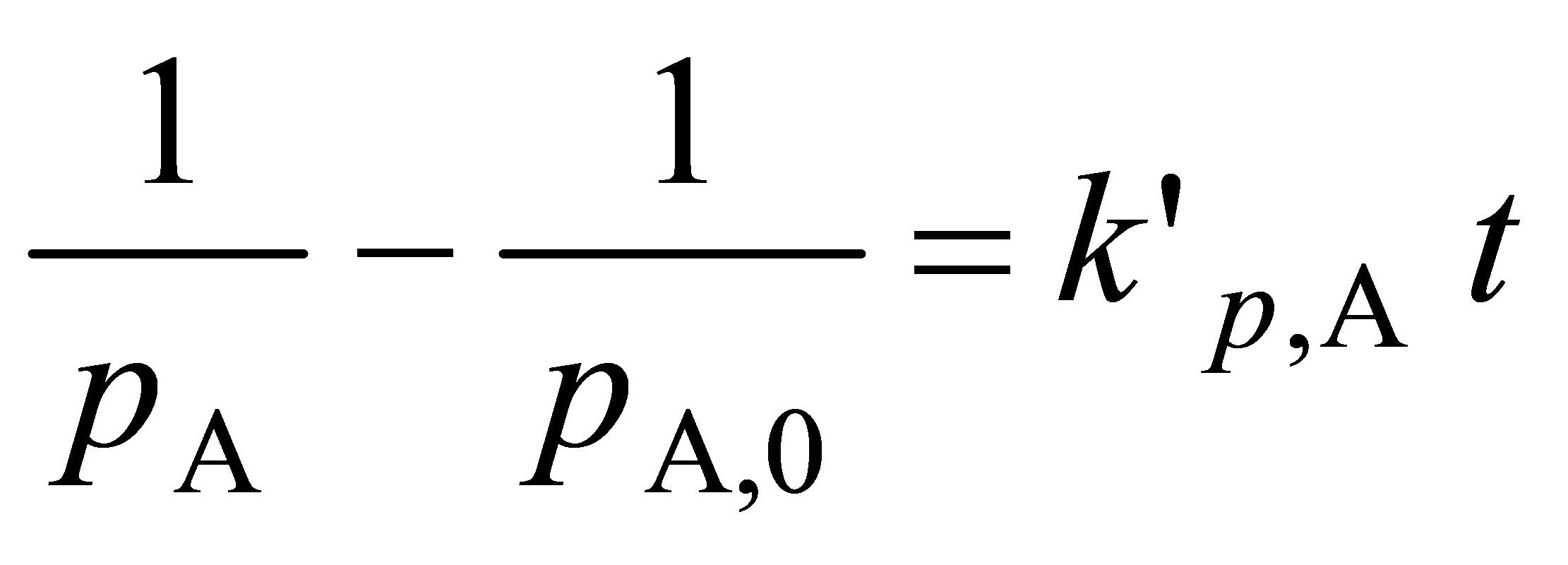
以p代表t=0时的总压,pt代表t=t时的总压,则不同时刻各组分的分压及总压如下:
A(g) + 2B(g) Z(g)
t = 0 pA,0 2pA,0 0 p0=3pA,0
t = t pA 2pA pA,0pA pt=2pA+pA,0
于是求得 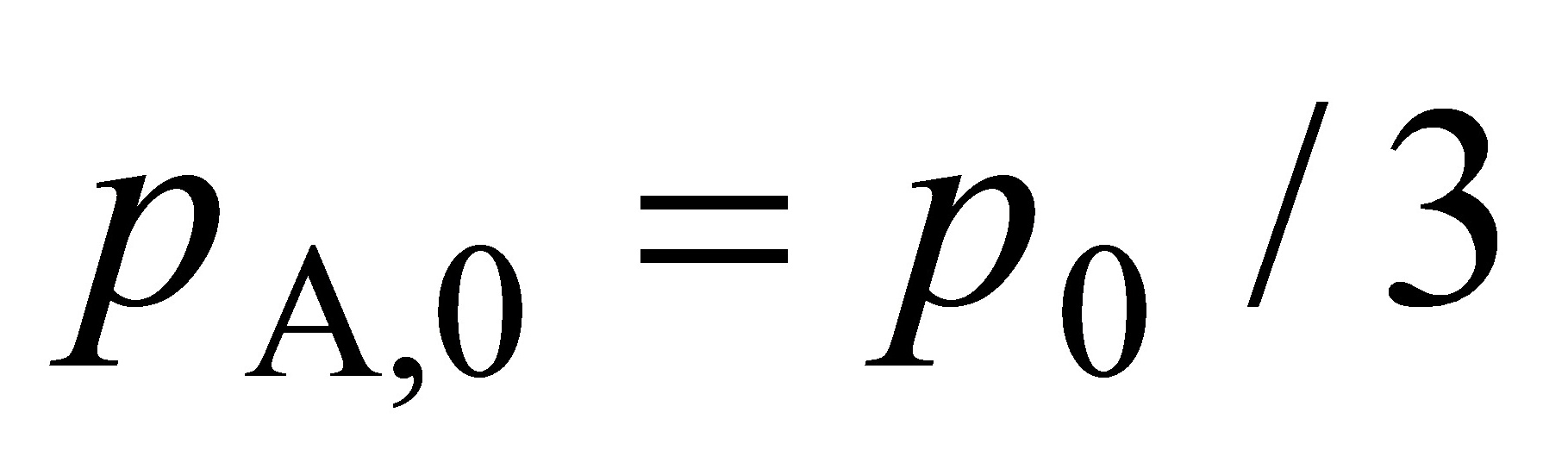 =3.36kPa/3=1.12kPa
=3.36kPa/3=1.12kPa
t = 1000s时 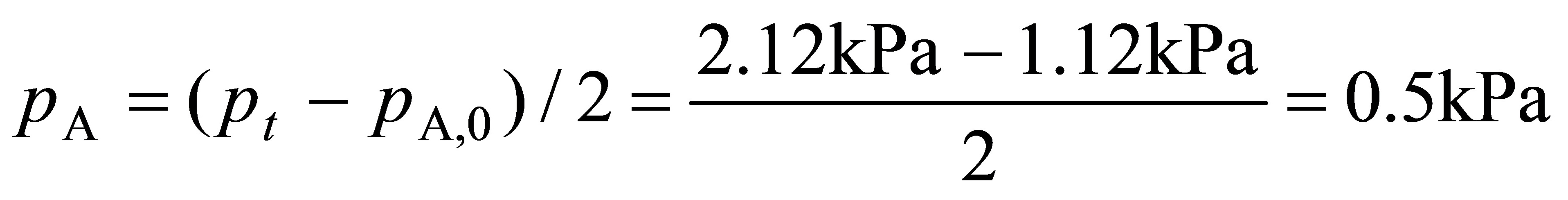
因此
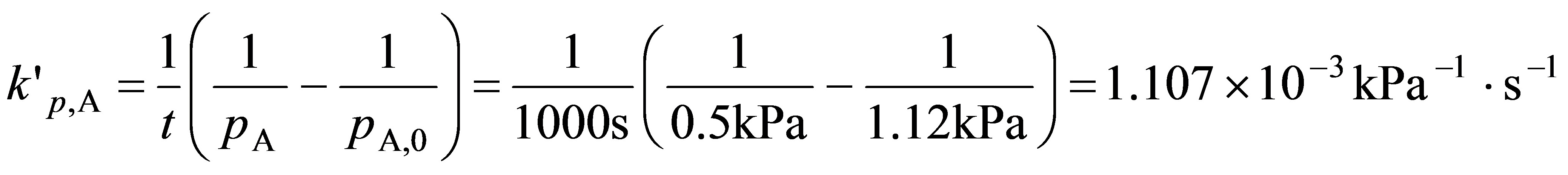
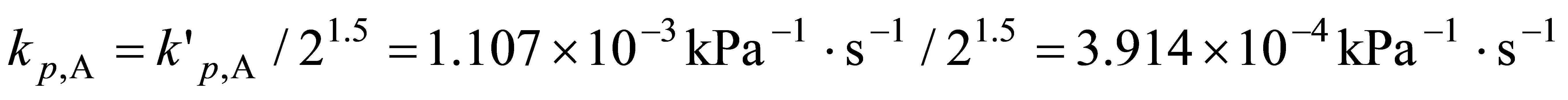
根据式(11.1.18) 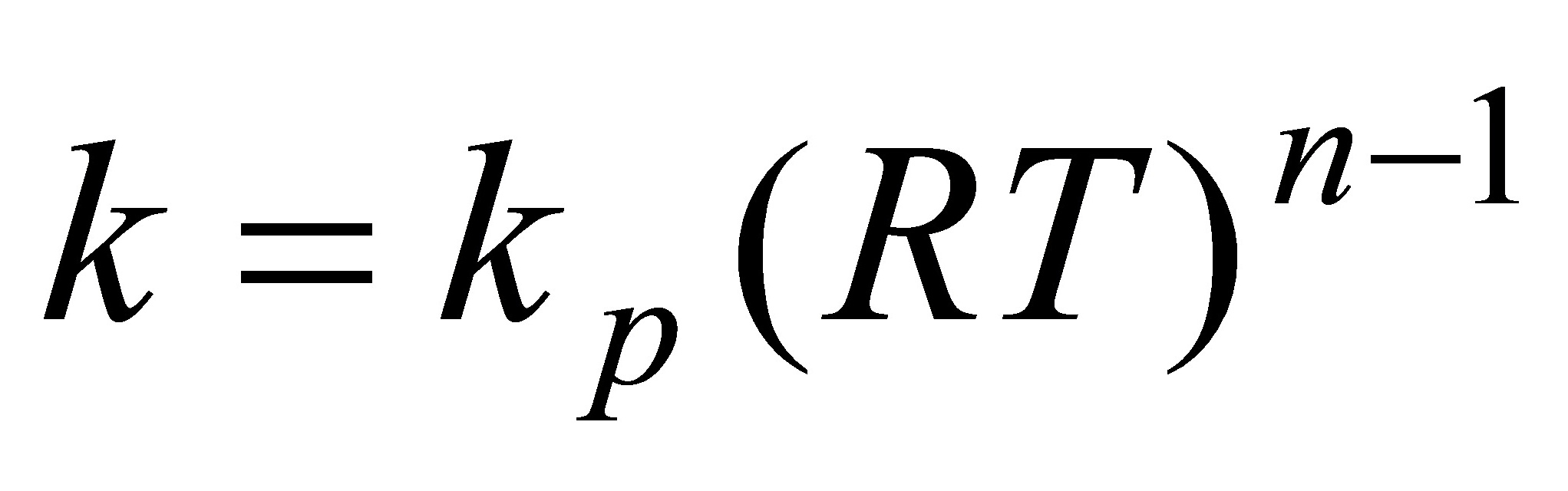 ,故基于浓度表示的速率常数为
,故基于浓度表示的速率常数为
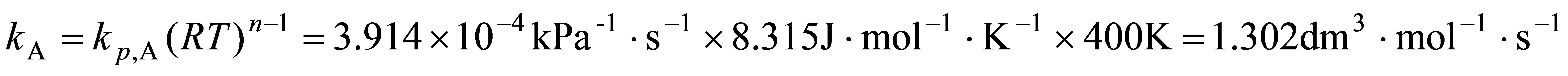 根据半衰期的定义
根据半衰期的定义
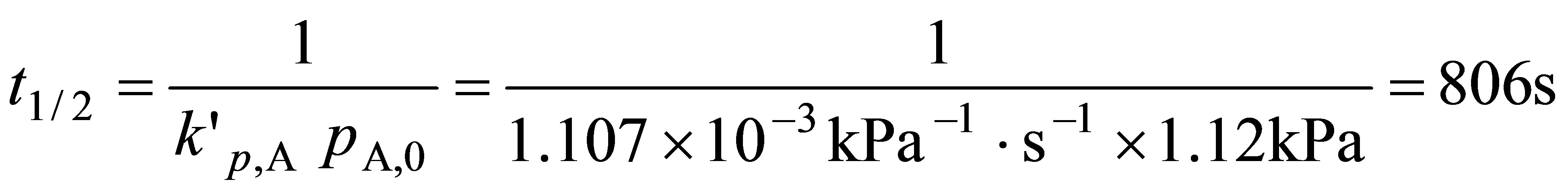
本题亦可由
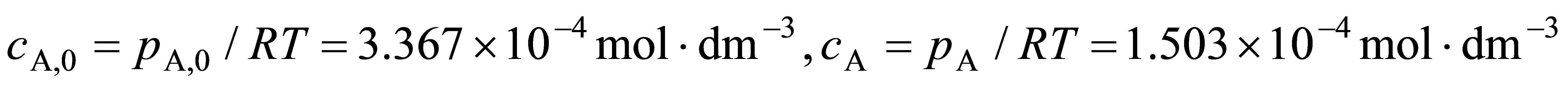 ,代放
,代放
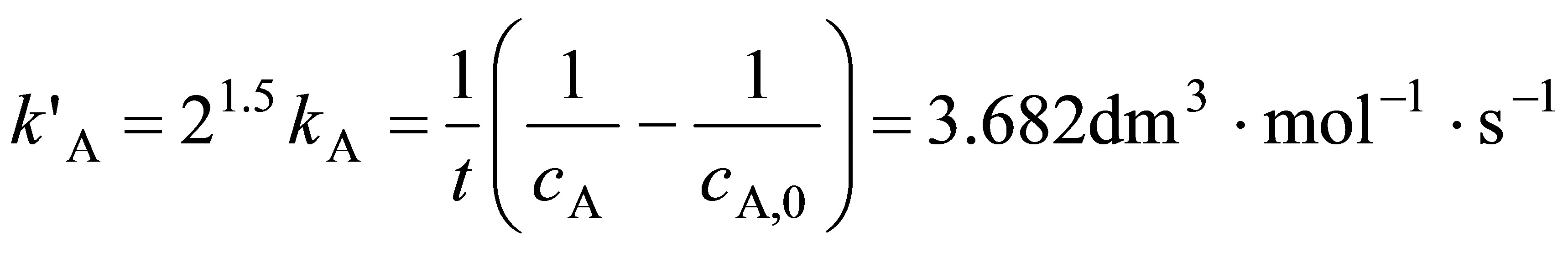
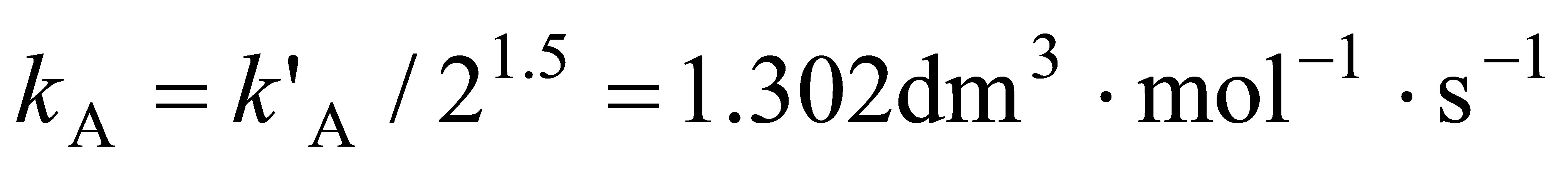
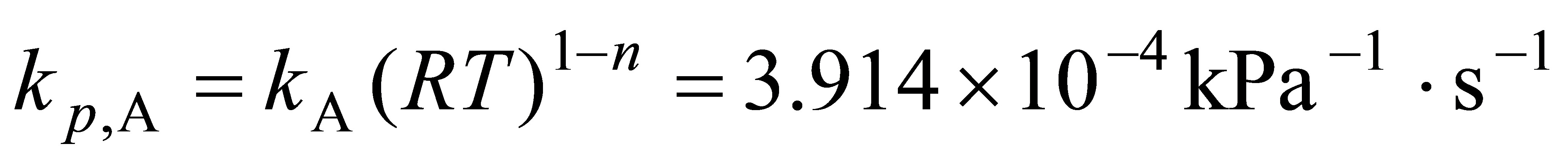
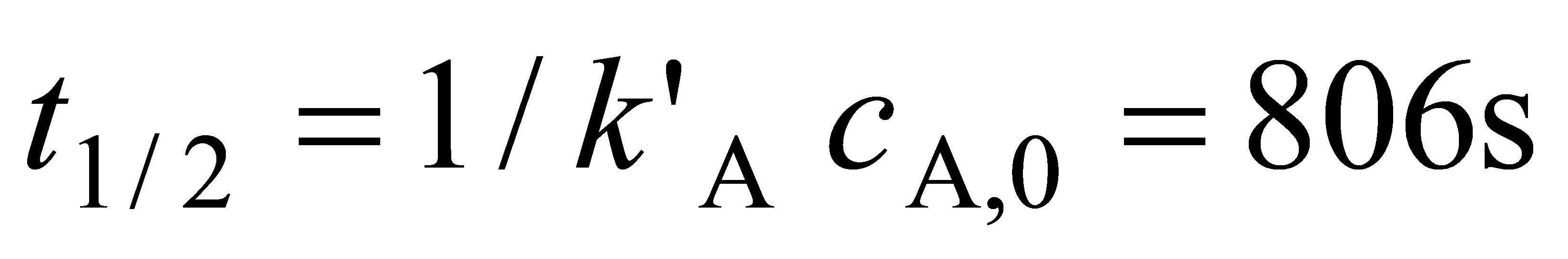
解析
步骤 1:确定反应物和产物的分压
反应开始时,容器内总压为3.36kPa,反应物A(g)和B(g)按化学计量比引入,即A(g)和B(g)的分压分别为1.12kPa和2.24kPa。反应进行1000s后,总压降至2.12kPa,此时A(g)的分压为0.5kPa,B(g)的分压为1.0kPa,Z(g)的分压为0.62kPa。
步骤 2:建立速率方程
根据反应物A(g)和B(g)的反应分级数分别为0.5和1.5,建立速率方程为:
$-d{C}_{A}/dt={k}_{A}{C}_{A}^{0.5}{C}_{B}^{1.5}$
步骤 3:计算速率常数
将反应开始时和反应进行1000s后的分压代入速率方程,计算速率常数${k}_{p,A}$:
${k}_{p,A}={2}^{1.5}\cdot \dfrac {1}{{1000s}}\cdot \dfrac {1.12kPa-0.5kPa}{1.12kPa^{0.5}\cdot 2.24kPa^{1.5}}=3.914\times {10}^{-4}kp{a}^{-1}\cdot {s}^{-1}$
步骤 4:计算半衰期
根据半衰期的定义,计算半衰期${t}_{1/2}$:
${t}_{1/2}=\dfrac {1}{{k}_{A}{C}_{{A}_{0}}^{0.5}}=\dfrac {1}{3.914\times {10}^{-4}kp{a}^{-1}\cdot {s}^{-1}\times 1.12kpa^{0.5}}=806s$
反应开始时,容器内总压为3.36kPa,反应物A(g)和B(g)按化学计量比引入,即A(g)和B(g)的分压分别为1.12kPa和2.24kPa。反应进行1000s后,总压降至2.12kPa,此时A(g)的分压为0.5kPa,B(g)的分压为1.0kPa,Z(g)的分压为0.62kPa。
步骤 2:建立速率方程
根据反应物A(g)和B(g)的反应分级数分别为0.5和1.5,建立速率方程为:
$-d{C}_{A}/dt={k}_{A}{C}_{A}^{0.5}{C}_{B}^{1.5}$
步骤 3:计算速率常数
将反应开始时和反应进行1000s后的分压代入速率方程,计算速率常数${k}_{p,A}$:
${k}_{p,A}={2}^{1.5}\cdot \dfrac {1}{{1000s}}\cdot \dfrac {1.12kPa-0.5kPa}{1.12kPa^{0.5}\cdot 2.24kPa^{1.5}}=3.914\times {10}^{-4}kp{a}^{-1}\cdot {s}^{-1}$
步骤 4:计算半衰期
根据半衰期的定义,计算半衰期${t}_{1/2}$:
${t}_{1/2}=\dfrac {1}{{k}_{A}{C}_{{A}_{0}}^{0.5}}=\dfrac {1}{3.914\times {10}^{-4}kp{a}^{-1}\cdot {s}^{-1}\times 1.12kpa^{0.5}}=806s$