题目
2.欲使氨水的pH值增大,应加入的物质是 ()-|||-A.NH4Cl溶液 B.水-|||-C.K2SO4晶体(少量) D.HCl溶液

题目解答
答案
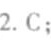
解析
本题考查弱碱性溶液中pH变化的判断,核心在于理解盐类水解和弱电解质电离平衡的影响因素。关键点在于分析各选项物质加入后对氨水电离平衡的作用:
- NH4Cl会引入NH4+,与NH3·H2O反应,抑制电离,使pH下降;
- 水稀释溶液,导致pH下降;
- K2SO4为强酸强碱盐,不水解,少量加入时不会破坏电离平衡,可能通过离子强度变化略微促进电离,使pH增大;
- HCl与NH3·H2O反应,消耗碱性成分,pH下降。
选项分析
A. NH4Cl溶液
NH4Cl是强酸弱碱盐,水解生成NH4+。NH4+与NH3·H2O发生反应:
$\text{NH}_4^+ + \text{NH}_3·\text{H}_2\text{O} \rightarrow 2\text{NH}_3 + \text{H}_2\text{O}$
消耗NH3·H2O,抑制其电离,OH⁻浓度降低,pH减小。
B. 水
稀释氨水时,虽然电离平衡右移,但总浓度降低更显著,OH⁻浓度整体下降,pH减小。
C. K2SO4晶体(少量)
K2SO4为强酸强碱盐,完全电离为K+和SO4^2-,不参与水解。少量加入时,离子强度增加,可能通过活度变化略微促进NH3·H2O电离,使OH⁻浓度略微上升,pH增大。
D. HCl溶液
HCl与NH3·H2O反应生成NH4Cl:
$\text{HCl} + \text{NH}_3·\text{H}_2\text{O} \rightarrow \text{NH}_4\text{Cl} + \text{H}_2\text{O}$
消耗NH3·H2O,OH⁻浓度大幅降低,pH减小。