题目
三、判断题(对的在括号内填"√",错的填"x")(共5题5分)-|||-1、金属铁比铜活泼,Fe可以置换 Cu^(2+), 因此三氯化铁不能腐蚀铜。[已知:-|||-^circ ((Fe)^2+iFe)=-0.44V , ^circ ((Cu)^2+/(u)=0.34V , ^circ ((Fe)^3+j(Fe^2+))=0.77N ]-|||-()-|||-2、25℃时,一定浓度的H2S水溶液中, ((H)^+):c((S)^2-)=2:1 ()-|||-3、HgS能溶于王水,王水中的硝酸是氧化剂,盐酸是配位剂。 ()-|||-4、由于 _(s)'((Ag)_(2)(C)_(1)(O)_(4))=1.12times (10)^-12lt (K)_(s)g(AgCl)=(1.77)^1times (10^10) 所以在白色AgCl沉-|||-淀中滴入黄色K2 CrO4溶液,会全部转化为Ag2 CrO4砖红色沉淀。 ()-|||-5、通常,反应活化能越小,反应速率系数越大,反应越快。 ()

题目解答
答案
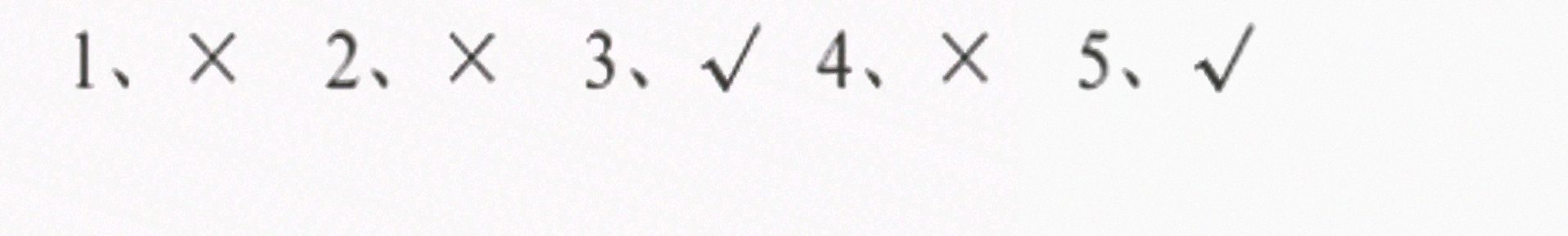
解析
步骤 1:判断Fe与Cu的电极电势
根据已知的电极电势 ${E}^{\theta }({Fe}^{2+}/Fe)=-0.44V$ 和 ${E}^{\theta }({Cu}^{2+}/Cu)=0.34V$ ,可以判断Fe比Cu更活泼,因此Fe可以置换 ${Cu}^{2+}$ 。
步骤 2:判断Fe3+与Cu的反应
根据已知的电极电势 ${E}^{\theta }({Fe}^{3+}/{Fe}^{2+})=0.77V$ ,可以判断Fe3+比Cu更活泼,因此Fe3+可以氧化Cu,即三氯化铁可以腐蚀铜。
步骤 3:判断H2S水溶液中H+与S2-的浓度比
在一定浓度的H2S水溶液中,H2S的电离方程式为H2S ⇌ H+ + HS-,HS- ⇌ H+ + S2-。由于H2S的电离是分步进行的,因此 $c({H}^{+}):c({S}^{2-})$ 不一定等于2:1。
步骤 4:判断HgS在王水中的溶解
HgS能溶于王水,王水中的硝酸是氧化剂,盐酸是配位剂,因此HgS在王水中可以被氧化并形成配位化合物。
步骤 5:判断AgCl沉淀转化为Ag2CrO4沉淀
由于 ${K}_{s}''{A}_{2}(r{O}_{4})=1.12\times {10}^{-12}\lt {Ks}_{s}'(AgCl)=1.77\times {10}^{-10}$ ,因此在白色AgCl沉淀中滴入黄色K2CrO4溶液,不会全部转化为Ag2CrO4砖红色沉淀。
步骤 6:判断反应活化能与反应速率的关系
通常,反应活化能越小,反应速率系数越大,反应越快。
根据已知的电极电势 ${E}^{\theta }({Fe}^{2+}/Fe)=-0.44V$ 和 ${E}^{\theta }({Cu}^{2+}/Cu)=0.34V$ ,可以判断Fe比Cu更活泼,因此Fe可以置换 ${Cu}^{2+}$ 。
步骤 2:判断Fe3+与Cu的反应
根据已知的电极电势 ${E}^{\theta }({Fe}^{3+}/{Fe}^{2+})=0.77V$ ,可以判断Fe3+比Cu更活泼,因此Fe3+可以氧化Cu,即三氯化铁可以腐蚀铜。
步骤 3:判断H2S水溶液中H+与S2-的浓度比
在一定浓度的H2S水溶液中,H2S的电离方程式为H2S ⇌ H+ + HS-,HS- ⇌ H+ + S2-。由于H2S的电离是分步进行的,因此 $c({H}^{+}):c({S}^{2-})$ 不一定等于2:1。
步骤 4:判断HgS在王水中的溶解
HgS能溶于王水,王水中的硝酸是氧化剂,盐酸是配位剂,因此HgS在王水中可以被氧化并形成配位化合物。
步骤 5:判断AgCl沉淀转化为Ag2CrO4沉淀
由于 ${K}_{s}''{A}_{2}(r{O}_{4})=1.12\times {10}^{-12}\lt {Ks}_{s}'(AgCl)=1.77\times {10}^{-10}$ ,因此在白色AgCl沉淀中滴入黄色K2CrO4溶液,不会全部转化为Ag2CrO4砖红色沉淀。
步骤 6:判断反应活化能与反应速率的关系
通常,反应活化能越小,反应速率系数越大,反应越快。