工业上以氟磷灰石[rm Ca_5F(PO_4)_3,含rm SiO_2等杂质]为原料生产磷酸和石膏,工艺流程如下:硫酸溶液 尾气 CO2 ①Na2CO3-|||-|②BaCO3-|||-氟硫灰石 酸解 过滤 粗磷酸 一 精制1 过滤 精制Ⅱ 口酸-|||-、-|||-洗涤液X ← 洗涤 结晶转化 →石有 滤渣回答下列问题;(1)酸解时有rm HF产生。氢氟酸与rm SiO_2反应生成二元强酸rm H_2SiF_6,离子方程式为 。(2)部分盐的溶度积常数见表。精制Ⅰ中,按物质的量之比rm (it n )(Na_2CO_3): (it n )(SiF_6^2-)=1:1加入rm Na_2CO_3脱氟,充分反应后,crm (Na^+)= rm molcdot L^-1;再分批加入一定量的rm BaCO_3,首先转化为沉淀的离子是 。硫酸溶液 尾气 CO2 ①Na2CO3-|||-|②BaCO3-|||-氟硫灰石 酸解 过滤 粗磷酸 一 精制1 过滤 精制Ⅱ 口酸-|||-、-|||-洗涤液X ← 洗涤 结晶转化 →石有 滤渣(3)rm SO_4^2-浓度(以rm SO_3%计)在一定范围时,石膏存在形式与温度、rm H_3PO_4浓度(以rm P_2O_5%计)的关系如图甲所示。酸解后,在所得rm 100℃、rm P_2O_5%为45的混合体系中,石膏存在形式为 (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 ,回收利用洗涤液X的操作单元是 ;一定温度下,石膏存在形式与溶液中rm P_2O_5%和rm SO_3%的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是 (填标号)。硫酸溶液 尾气 CO2 ①Na2CO3-|||-|②BaCO3-|||-氟硫灰石 酸解 过滤 粗磷酸 一 精制1 过滤 精制Ⅱ 口酸-|||-、-|||-洗涤液X ← 洗涤 结晶转化 →石有 滤渣A. rm 65℃、P_2O_5%=15、SO_3%=15 B. rm 80℃、P_2O_5%=10、SO_3%=20 C. rm 65℃、P_2O_5%=10、SO_3%=30 D. rm 80℃、P_2O_5%=10、SO_3%=10
工业上以氟磷灰石[$$\rm Ca_5F(PO_4)_3$$,含$$\rm SiO_2$$等杂质]为原料生产磷酸和石膏,工艺流程如下:
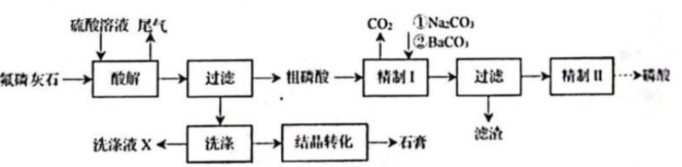
回答下列问题;
(1)酸解时有$$\rm HF$$产生。氢氟酸与$$\rm SiO_2$$反应生成二元强酸$$\rm H_2SiF_6$$,离子方程式为 。
(2)部分盐的溶度积常数见表。精制Ⅰ中,按物质的量之比$$\rm {\it n }(Na_2CO_3): {\it n }(SiF_6^{2-})=1:1$$加入$$\rm Na_2CO_3$$脱氟,充分反应后,$$c\rm (Na^+)=$$ $$\rm mol\cdot L^{-1}$$;再分批加入一定量的$$\rm BaCO_3$$,首先转化为沉淀的离子是 。
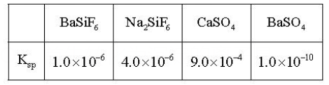
(3)$$\rm SO_4^{2-}$$浓度(以$$\rm SO_3\%$$计)在一定范围时,石膏存在形式与温度、$$\rm H_3PO_4$$浓度(以$$\rm P_2O_5\%$$计)的关系如图甲所示。酸解后,在所得$$\rm 100℃$$、$$\rm P_2O_5\%$$为45的混合体系中,石膏存在形式为 (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是 ,回收利用洗涤液X的操作单元是 ;一定温度下,石膏存在形式与溶液中$$\rm P_2O_5\%$$和$$\rm SO_3\%$$的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是 (填标号)。
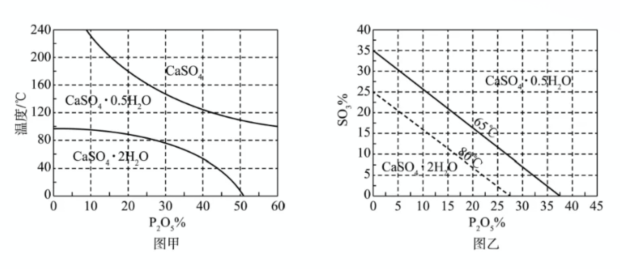
A. $$\rm 65℃、P_2O_5\%=15、SO_3\%=15$$
B. $$\rm 80℃、P_2O_5\%=10、SO_3\%=20$$
C. $$\rm 65℃、P_2O_5\%=10、SO_3\%=30$$
D. $$\rm 80℃、P_2O_5\%=10、SO_3\%=10$$
题目解答
答案
(1)$$\rm 6HF+{SiO}_{2}\!=\!=\!=2{H}^{+}+ {SiF}_{6}^{2-} +2{H}_{2} O$$
(2)①$$\rm 2×{10}^{-2} $$;②$$\rm {SO}_{4}^{2-} $$
(3)①$$\rm {CaSO}_{4} \cdot 0.5{H}_{2} O$$;②减少$$\rm {CaSO}_{4} $$的溶解损失,提高产品石膏的产率;③酸解;④D
解析
氢氟酸与二氧化硅反应生成二元强酸$$\rm H_2SiF_6$$,反应方程式为$$\rm 6HF+SiO_2=H_2SiF_6+2H_2O$$。
步骤 2:将反应方程式转换为离子方程式
将反应方程式转换为离子方程式,即$$\rm 6HF+SiO_2=2H^++SiF_6^{2-}+2H_2O$$。
【答案】
$$\rm 6HF+SiO_2=2H^++SiF_6^{2-}+2H_2O$$
(2)部分盐的溶度积常数见表。精制Ⅰ中,按物质的量之比$$\rm {\it n }(Na_2CO_3): {\it n }(SiF_6^{2-})=1:1$$加入$$\rm Na_2CO_3$$脱氟,充分反应后,$$c\rm (Na^+)=$$_____$$\rm mol\cdot L^{-1}$$;再分批加入一定量的$$\rm BaCO_3$$,首先转化为沉淀的离子是_____。
【解析】
步骤 1:计算$$\rm Na^+$$的浓度
根据$$\rm {\it n }(Na_2CO_3): {\it n }(SiF_6^{2-})=1:1$$,加入$$\rm Na_2CO_3$$脱氟,充分反应后,$$\rm Na^+$$的浓度为$$\rm 2×10^{-2}mol\cdot L^{-1}$$。
步骤 2:确定首先转化为沉淀的离子
根据溶度积常数,$$\rm BaSO_4$$的溶度积常数最小,因此首先转化为沉淀的离子是$$\rm SO_4^{2-}$$。
【答案】
$$\rm 2×10^{-2}mol\cdot L^{-1}$$;$$\rm SO_4^{2-}$$
(3)$$\rm SO_4^{2-}$$浓度(以$$\rm SO_3\%$$计)在一定范围时,石膏存在形式与温度、$$\rm H_3PO_4$$浓度(以$$\rm P_2O_5\%$$计)的关系如图甲所示。酸解后,在所得$$\rm 100℃$$、$$\rm P_2O_5\%$$为45的混合体系中,石膏存在形式为_____(填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是_____,回收利用洗涤液X的操作单元是_____;一定温度下,石膏存在形式与溶液中$$\rm P_2O_5\%$$和$$\rm SO_3\%$$的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是_____(填标号)。
【解析】
步骤 1:确定石膏存在形式
根据图甲所示,酸解后,在所得$$\rm 100℃$$、$$\rm P_2O_5\%$$为45的混合体系中,石膏存在形式为$$\rm CaSO_4·0.5H_2O$$。
步骤 2:解释使用硫酸溶液的原因
洗涤时使用一定浓度的硫酸溶液而不使用水,原因是减少$$\rm CaSO_4$$的溶解损失,提高产品石膏的产率。
步骤 3:确定回收利用洗涤液X的操作单元
回收利用洗涤液X的操作单元是酸解。
步骤 4:确定能实现酸解所得石膏结晶转化的条件
根据图乙所示,能实现酸解所得石膏结晶转化的条件是D。