题目
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。 Cu 石墨 A.电解过程中,铜电极上有H2产生 B.电解初期,主反应方程式为Cu+H2SO4Cu 石墨CuSO4+H2↑ C.电解一定时间后,石墨电极上有铜析出 D.整个电解过程中,H+的浓度不断增大
某同学按如图所示的装置进行电解实验。下列说法正确的是( )。
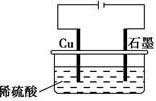

| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
题目解答
答案
BC
B. 电解初期,主反应方程式为Cu+H₂SO₄嚣CuSO₄+H₂↑
C. 电解一定时间后,石墨电极上有铜析出
B. 电解初期,主反应方程式为Cu+H₂SO₄嚣CuSO₄+H₂↑
C. 电解一定时间后,石墨电极上有铜析出
解析
本题考查电解池的工作原理,需结合电极材料的活泼性及溶液中离子的放电顺序进行分析。解题关键在于:
- 判断阴阳极:铜为活泼金属,优先作为阳极被氧化,石墨为阴极。
- 分析反应阶段:电解初期,溶液中H⁺被还原;随反应进行,Cu²⁺浓度增加,后续Cu²⁺优先于H⁺放电。
- 溶液浓度变化:电解过程中H⁺被消耗,硫酸浓度可能变化,需综合反应式判断。
选项分析
A.电解过程中,铜电极上有H₂产生
错误。铜为阳极,发生氧化反应:
$\text{Cu} \rightarrow \text{Cu}^{2+} + 2e^-$
H₂的产生只能在阴极发生,与铜电极无关。
B.电解初期,主反应方程式为Cu+H₂SO₄通电→CuSO₄+H₂↑
正确。
- 阳极:Cu被氧化为Cu²⁺
- 阴极:H⁺被还原为H₂
整体反应为:
$\text{Cu} + \text{H}_2\text{SO}_4 \xrightarrow{\text{通电}} \text{CuSO}_4 + \text{H}_2↑$
C.电解一定时间后,石墨电极上有铜析出
正确。
随着Cu²⁺浓度增加,阴极反应变为:
$\text{Cu}^{2+} + 2e^- \rightarrow \text{Cu}$
因此石墨电极(阴极)会有铜析出。
D.整个电解过程中,H⁺的浓度不断增大
错误。
电解过程中H⁺被消耗生成H₂,且硫酸浓度逐渐降低(因生成CuSO₄),H⁺浓度会减小。